Androgenlərə həssaslıq sindromu
Androgenlərə həssaslıq sindromu ing. Androgen insensitivity syndrome — AIS (androgen müqavimət sindromu, Morris sindromu, testikulyar feminizasiya sindromu) androgen reseptorları vasitəsilə gendə baş verən mutasiyalar nəticəsində, cinsi inkişaf dövründə yaranan anadangəlmə endokrinologiya variasiyadır.[1] Belə sindromlar anormal reseptorun strukturundan və həssaslığından asılı olaraq dəyişir. Bu sindromdan əziyyət çəkən şəxslərin bədənləri müəyyən kişi cinsi hormonlarına (androgenlər adlanır) cavab verə bilmədiklərindən, onlar tez-tez qadın cinsi xüsusiyyətlərinə malikdirlər və ya həm kişi, həm də qadın cinsi inkişafının əlamətlərini göstərirlər.[2][3][4] Androgenə qarşı həssaslıq sindromu yalnız Y xromosomuna sahib şəxslərdə qeydə alınır.[2] Sindroma xas olan xüsusiyyətlərdən biri də X xromosomunun resessiv irsilik ilə əlaqəli olmasıdır.
Androgenə həssaslıq sindromunun cinsiyyət orqanlarının kişiləşmə dərəcəsinə görə üç növü ayırd edilir:
- tam androgenə həssaslıq sindromu (xarici cinsiyyət orqanının qadın fenotipinə malik olduğu);
- yüngül androgenə həssaslıq sindromu (xarici cinsiyyət orqanında kişi fenotipi olduqda) ;
- qismən androgenə həssaslıq sindromu (xarici cinsiyyət orqanları qismən kişiləşdikdə).
Bu vəziyyətdə olan xəstələrə kömək etmək üçün simptomatik üsullardan istifadə edilir. Müasir dövrdə AR genindəki mutasiyalar nəticəsində yaranan, anormal fəaliyyət göstərən androgen reseptor zülalların fəaliyyətini düzəltmək üçün heç bir üsul yoxdur. Tibbi yardım üsullarına isə genitoplastika (xəstənin istəyi ilə), gonadektomiya (şiş riskinin inkişafı hallarında), hormon əvəzedici terapiya, genetik məsləhət və psixoloji dəstək kimi üsullar aid edilir.[5][6][7][8][9][10][11][12][13]

Genetika
[redaktə | mənbəni redaktə et]
İnsan androgen reseptoru (AR) X xromosomunun (lokus Xq11-Xq12) proksimal uzun qolunda yerləşən gen tərəfindən kodlanmış bir zülaldır.[14] Zülal kodlaşdırma bölgəsi təxminən 2757 nukleotiddən (919 kodon) ibarət, səkkiz ekzonu əhatə edən 1–8 və ya AH şəklində təyin edilir.[2] İntronların ölçüləri 0,7 ilə 26 kb arasında dəyişir. Digər nüvə reseptorları kimi AR zülalı da bir neçə funksional domendən ibarətdir.[2][6][13] Bunlar transaktivasiya sahəsi (həmçinin transkripsiya tənzimləmə sahəsi və ya amin/NH2 terminal domeni adlanır), DNT bağlayan domen, menteşə bölgəsi və steroid bağlayan domendir(karboksil liqand bağlayan sahə). Transaktivasiya sahəsi ekson 1 tərəfindən kodlanır və AR zülalının yarısından çoxunu təşkil edir. 2 və 3-cü ekzonlar DNT-ni birləşdirən sahəni, 4-cü ekzonun 5-ci hissəsi isə menteşə bölgəsini kodlayır. 4-dən 8-ə qədər olan ekzonların qalan hissəsi liqand bağlama domenini kodlaşdırır.
AR genindəki mutasiyalar
[redaktə | mənbəni redaktə et]2010-cu ildən etibarən AR mutasiya məlumat bazasında bu genin 400-dən çox mutasiya növü qeydə alınmışdır və onların sayı gün keçdikcə artmaqdadır.[6] Nəsildən-nəslə ötürülmə adətən ana xətti və X resessiv ötürülmə vasitəsilə baş verir.[2][15] Təxminən 30% hallarda AR gen mutasiyası spontan xarakter daşıyır və ötürülmür[10] Bu cür de novo mutasiyaları valideynlərdən birinin cinsiyyət orqanında olan qonosit mutasiyasının, mayalanmış yumurta hüceyrənin özündə olan mutasiyaların təsiri nəticəsində yaranır.[16] Aparılan araşdırmalar nəticəsində, səkkiz de novo mutasiyalarından üçünün postziqotik olaraq baş verdiyi müəyyən edilmişdir.[17] Lakin hər AR gen mutasiyası androgen həssaslığı ilə nəticələnmir.[2] Belə ki, xüsusi mutasiya genetik kişilərin 8–14%-də baş verir və digər genetik faktorlarla birgə mövcud olduqda mənfi təsir göstərdiyi düşünülür.[18][19][20][21][22]
Digər səbəbləri
[redaktə | mənbəni redaktə et]Tam və ya qismən həssaslığı olan bəzi fərdlərdə androgen həssaslıq sindromunun diaqnozunun qoyulması üçün tələb olunan bütün klinik, hormonal və histoloji xüsusiyyətlərin müəyyən olunmasına baxmayaraq, AR gen mutasiyaları olmaya da bilir.[6][8][23] Tam androgen həssaslığı olan qadınların 5%-ə qədərində,[24] qismən androgen həssaslığı olan insanların isə 27% ilə 72% arasında AR gen mutasiyaları yoxdur. Bəzən xəstələrdə qismən androgen həssaslığının olmasının əsas səbəbi steroidogen faktor-1 (SF-1) zülalında mutasiyanın olmasıdır.[25] Tam androgen həssaslığı, normal androgen reseptorunun N-terminal bölgəsindən hüceyrənin əsas transkripsiya mexanizminə transaktivasiya siqnalının ötürülməsində yaranan çatışmazlıq nəticəsində baş verdiyi hallarda müşahidə edilmişdir.[26]
XY karyotipi
[redaktə | mənbəni redaktə et]46, XY, karyotipi olan insanda mutasiyadan asılı olaraq həm kişi, həm də qadın fenotipi ola bilər. Belə şəxslərdə cinsi vəzilər Y xromosomunun mövcudluğuna görə fenotipindən asılı olmayaraq testislər olur.[27] 46, XY karyotipinə sahib olan bir insan 46, XX, karyotipi olan bir qadından xarici görünüşü ilə fərqlənməsə də, yumurtalıqlara və uşaqlığa sahib deyildir.[28]
Androgenə qarşı həssas olan insanlar azlıq təşkil edir. Lakin bu qrupa aid kişilər barədə bir neçə məqalə dərc edilmişdir. Sonsuzluq bu qrup arasında geniş yayılsa da, testesteron vasitəsilə spermatozoidlərin sayını artırdıqdan sonra uşaq sahibi ola bilən nümunələr də vardır. Androgen həssaslığı olan kişidən dünyaya gələn oğul övladı atasından X xromosomunu almadığına görə bu xəstəlikdən əziyyət çəkməyəcəkdir. Lakin dünyaya gələn qız övlad atasından X xromosomunu aldığına görə daşıyıcı sayılır.[29][30][31][32][33],[13][2][34]
XX karyotipi
[redaktə | mənbəni redaktə et]Qadın genetikasında (karyotip 46, XX) iki X xromosomu olduğuna görə AR genlərinin sayı da ikidir. Genlərdən biri digərinə nisbətən daha az mutasiyaya uğrayır.[29] Belə qadınlar mutasiya daşıyıcısıdırlar. Bu zaman X xromosomunun inaktivasiyası ilə əlaqədar olaraq daşıyıcılarda bədən tüklərində azalma, cinsi yetkinliyin gecikməsi və boyun normadan artıq uzanması qeydə alınmışdır. Qadın daşıyıcılarda mutasiyaya uğramış AR geninin uşaqlarına ötürülməsi ehtimalı 50%-dir. Əgər mutasiyanın ötürüldüyü uşaq genetik olaraq qadındırsa mutasiya daşıyıcısı olacaqdır, genetik olaraq kişidirsə androgen həssaslığına məruz qalacaqdır. Androgen həssaslığı olan bir kişi ilə genində de novo mutasiyasının olduğu qadının birləşməsindən, hər iki AR genində mutasiyaları olan qadın əmələ gəlir. Lakin belə bir halın meydana gəlməsi demək olar ki, mümkünsüzdür. 2010-cu ildə edilən araşdırmalarda da belə bir hala rast gəlinməmişdir.
Patofiziologiya
[redaktə | mənbəni redaktə et]Dölün inkişafında androgenlər
[redaktə | mənbəni redaktə et]İnsan embrionları ilk altı həftə ərzində genetik cinsindən (46, XX və ya 46, XY) asılı olmayaraq eyni şəkildə inkişaf edir. Bu müddət ərzində 46, XX və ya 46, XY embrionları arasındakı fərqi izah etməyin yeganə yolu Barr cisimlərini və ya Y xromosomunu axtarmaqdır.[36] Bu zaman gonadlar genital qabarcıq adlanan toxuma çıxıntıları şəklində olurlar.[36] Beşinci həftəyə yaxın genital toxuma çıxıntıları cinsiyyət orqanlarına çevrilirlər. Altıncı həftədə cinsiyyət vəziləri genetik cinsinə görə fərqlənməyə başlayır. Əgər karyotip 46, XY olarsa, SRY geninin Y xromosomuna təsiri nəticəsində testislər inkişaf edirlər. Bu prosesin baş verməsi üçün androgenin və ya funksional androgen reseptorunun olması tələb olunmur.
İnkişafın yeddinci həftəsinə qədər embrionda Müllerian və Volffiandan ibarət müxtəlif kanallar vardır.[36] Bu dövrdə testislərdə olan Sertoli hüceyrələri Müllerian kanallarının inkişafını dayandırmaq və onların degenerasiyasına səbəb olmaq üçün anti-Müllerian hormonu ifraz edirlər.[36] Bu hormonun ifrazı dayanarsa Müllerian kanalları qadın reproduktiv orqanlarına (uşaqlıq, uşaqlıq boynu, fallopiya boruları və yuxarı vagina) çevrilir.[36] Müller kanallarından fərqli olaraq Volf kanallarında azalma müşahidə edilmir.[37] Testosteron və funksional androgen reseptorlarının iştirakı ilə Volf kanalları epididim, vas deferens və seminal veziküllərə çevrilirlər.[36] Əgər testislər testosteronu ifraz edə bilmirlərsə və ya androgen reseptorları düzgün fəaliyyət göstərmirsə Wolff kanalları degenerasiyaya uğrayırlar.[38]
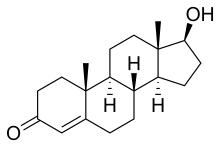
Kişi cinsiyyət orqanlarının maskulinləşməsi həm testosterondan, həm də dihidrotestosterondan asılıdır.[35] Kişi xarici cinsiyyət orqanlarının, eləcə də prostat vəzinin maskulinizasiyasına androgen dihidrotestosteron da təsir göstərir. Testosteron 5-alfa reduktaza fermenti tərəfindən dihidrotestosterona çevrilir. Bu ferment az miqdarda ifraz edildikdə dihidrotestosteron əmələ gəlmir və xarici kişi cinsi orqanı düzgün inkişaf etmir. Daxili kişi orqanlarında olduğu kimi dihidrotestosteron da inkişafda iştirak edən genlərin transkripsiyasını tənzimləmək üçün funksional androgen reseptoruna ehtiyac duyur.[39][40][41][42][43]
Androgenlərə qarşı həssaslığın patogenezi
[redaktə | mənbəni redaktə et]Androgen reseptor genindəki mutasiyalar androgen reseptor zülalının sintezindən tutmuş dimerləşmiş androgen AR kompleksinin transkripsiya qabiliyyətinə qədər androgenləşmənin istənilən mərhələsində problemlər yarada bilərlər. Androgen həssaslığı bu hadisələrdən ən azı birinin baş verməsi ilə nəticələnə bilər. AR-ni aktivləşdirmək və gen ifadəsini tənzimləmək üçün bu mərhələlərin hər biri düzgün qaydada getməlidir. Müəyyən bir mutasiyanın məhz hansı proseslərə müdaxilə edəcəyini mutasiyanın yerləşdiyi AR bölgəsini müəyyən etməklə proqnozlaşdırmaq olar. Bu proqnozlaşdırma qabiliyyəti əsasən retrospektiv xarakter daşıyır. AR geninin müxtəlif funksional sahələri AR-nin müxtəlif bölgələrindəki spesifik mutasiyaların təsirlərini öyrənməklə müəyyən edilir.[37] Məsələn, steroid bağlayan domendəki mutasiyaların androgen bağlama yaxınlığına və ya saxlanmasına, menteşə bölgəsindəki mutasiyaların nüvə translokasiyasına, DNT bağlama domenindəki mutasiyaların isə dimerləşməyə və hədəf bağlanmasına təsir etdikləri sübut edilmişdir. Məlumdur ki, DNT və transaktivasiya sahəsində mutasiyalar hədəf gen transkripsiyasının tənzimlənməsinə təsir göstərir. Təsirə məruz qalan funksional sahə məlum olsa belə, müəyyən mutasiyanın fenotipik nəticələrini proqnozlaşdırmaq çətindir.
Bəzi mutasiyalar birdən çox funksional sahəyə mənfi təsir göstərə bilirlər.[37] Məsələn, bir funksional domendəki mutasiya domenlərin qarşılıqlı təsirini dəyişdirir və digərinə zərərli təsir göstərir. Vaxtından əvvəl dayanma kodonu və ya çərçivə xətası olarsa, tək mutasiya bütün aşağı axın funksional sahələrə təsir göstərir. Belə bir mutasiya tamamilə yararsız (və ya sintez olunmayan) androgen reseptor zülalının əmələ gəlməsi ilə nəticələnə bilər. Steroid bağlayan domen genin sonunda meydana gəldiyi üçün vaxtından əvvəl dayanma kodonlarının və ya yanlış çərçivənin təsirlərinə xüsusilə həssasdır. Bu səbəbdən onun məlumatı digər funksional sahələrə nisbətən daha az ötürülür və yanlış şərh olunur.
AR geninin mutasiyası zamanı daha mürəkkəb nəticələr müşahidə edilmişdir. Kişi fenotip mutasiyaları kişi döş xərçəngi, prostat xərçəngi, onurğa və bulbar əzələ atrofiyası xəstəlikləri ilə əlaqəli ola bilir. Qismən androgen həssaslığı olan bəzi kişilərdə görülən döş xərçənginin bir forması AR-nin DNT-ni bağlayan sahəsindəki mutasiyadan qaynaqlanır. Bu mutasiyanın xərçəng hüceyrələrinin böyüməsinə səbəb olaraq, estrogen reseptor zülalı ilə AR genin qarşılıqlı təsirinin pozulmasına səbəb olduğu düşünülür.[44][45] Onurğa və bulbar əzələ atrofiyasının patogenezi göstərir ki, hətta mutant AR zülalının özü də patologiyaya səbəb ola bilər. Bu atrofiya ilə əlaqəli olan AR geninin poliqlatamin traktının trinukleotidin genişlənməsi, səhv istiqamə dönmüş AR zülalının sintezinə gətirib çıxarır ki, bu da hüceyrənin lazımi şəkildə proteolizə edə bilmir. Bu zaman AR zülalları hüceyrənin sitoplazmasında və nüvəsində aqreqatlar əmələ gətirir. 30–50 il ərzində bu aqreqatlar yığılır və sitotoksik təsir göstərirlər. Nəticədə atrofiya ilə əlaqəli neyrodegenerativ simptomlara səbəb olurlar.[46]
Diaqnostika
[redaktə | mənbəni redaktə et]
Androgen həssaslığının müəyyən edilməsi üçün bir sıra diaqnostik müayinələrin olunması vacibdir.[47] Androgen həssaslığını göstərən klinik əlamətlər arasında kor vajinanın olması,[48] cinsiyyət orqanının maskulinizasiyasının olmaması,[2][49][39] Müller kanallarının qismən və ya tam reqressiyası, ikitərəfli displastik olmayan testislər, pozulmuş spermatogenez, virilizasiya, postpubertal testosteron, luteinizing hormon və estradiolun normal və ya yüksəlmiş səviyyələri kimi əlamətlər vardır. Bu zaman genital dəri fibroblastlarının androgen bağlama aktivliyi azalır,[50] testosteronun dihidrotestosterona çevrilməsi pozulur.[51] Androgen reseptor[52][53] geninin ardıcıllığında mutasiya[54] aşkar edilərsə diaqnoz təsdiqlənir. Androgenə qarşı həssaslığın hər üç növünün (tam, qismən və yüngül androgen həssaslığı) öz diferensial diaqnoz siyahısı vardır.[55][56][57] Şübhəli vəziyyətin formasından asılı olaraq həmin növlər ayırd edilir.
- Xromosom aberrasiyaları:
- Klaynfelter sindromu (karyotip 47, XXY)
- Şereşevski – Terner sindromu (karyotip 45, XO)
- Qarışıq cinsiyyət orqanlarının disgenezi (karyotip 45, XO / 46, XY)
- Tetraqametik kimerizm (karyotip 46, XX / 46, XY)
- Karyotip 46, XY olan şəxslərdə androgen biosintetik disfunksiyası:
- Luteinizing hormon (LH) reseptor mutasiyaları
- Smith-Lemli-Opitz sindromu (zehni geriləmə ilə əlaqəli)
- Lipoid konjenital adrenal hiperplaziyası
- 3-beta-hidroksisteroid dehidrogenaz çatışmazlığı səbəbindən CAH
- 17-alfa-hidroksilaza çatışmazlığı səbəbindən CAH
- 17.20 lyase çatışmazlığı
- 17β-hidroksisteroid dehidrogenaz III çatışmazlığı
- 5-alfa reduktaza çatışmazlığı
- 46. XX insanda androgen artıqlığı:
- 21-hidroksilaza çatışmazlığı səbəbindən CAH
- 3-beta-hidroksisteroid dehidrogenaz çatışmazlığı səbəbindən CAH
- Sitokrom P450 oksidoreduktaza çatışmazlığı
- 11-beta-hidroksilaza çatışmazlığı səbəbindən CAH
- Aromataz çatışmazlığı
- Qlükokortikoid reseptorlarının mutasiyaları
- Qadınlığın virilizəedici şişi (məsələn, luteoma)
- Ana bətnində androgenin təsirinin artması
- İnkişafla əlaqəli
- Mayer-Rokitanski-Kuster-Hauzer sindromu (karyotip 46, XX)
- Svyer sindromu (karyotip 46, XY)
- XX cinsiyyət orqanlarının disgenezi (46, XX karyotip)
- Leydig hüceyrə hipoplaziyası
- Anorxizm
- Ovotestikulyar NFP
- NFP testisləri
- Teratogen səbəblər (məsələn, estrogenlər, antiestrogenlər)
- Digər:
- Fraser sindromu (proqressiv glomerulopatiya ilə əlaqəli)
- Denis-Drash sindromu (nefropatiya və Vilms şişi ilə əlaqəli)
- VAGR sindromu (Vilms şişi və aniridiya ilə əlaqəli)
- Mak Kusik-Kaufman sindromu (postaksial polidaktiliya ilə əlaqəli)
- Robinov sindromu (cırtdanlıq ilə əlaqəli)
- Aarskoq-Scott sindromu (üz anomaliyaları ilə əlaqəli)
- Əl ayaq genital sindromu (əzaların qüsurları ilə əlaqəli)
- Popliteal pterygium sindromu (dizlərin arxasında geniş toxuma ilə əlaqəli)
- Kallman sindromu (tez-tez anosmiya ilə əlaqələndirilir)
- Hipospadiya
- Kriptorxizm
- Vajinal atreziya
Epidemiologiya
[redaktə | mənbəni redaktə et]Androgenlərə qarşı həssaslıq sindromu çox kiçik nümunələr əsasında müəyyən edildiyinə görə dəqiq hesab edilmir.[2] Tam androgen həssaslığının 46, XY karyotipi olan fərdlərdə 20,400 doğuşdan birində rast gəlindiyi müəyyən edilmişdir.[58] Hollandiyada ümummilli sorğu aparılan zaman diaqnozlarının genetik təsdiqi olan xəstələrin 99.000-dən birində tam həssaslıq müəyyən edilmişdir.[59] Qismən androgen həssaslığına isə 130.000-də 1 nəfərdə rast gəlinir.[60] Yüngül androgen həssaslığı isə yoxlanılmamışdır və ona görə də onun həqiqi yayılma nisbəti məlum deyildir.[6]
Tarixi
[redaktə | mənbəni redaktə et]Bu sindrom əvvəllər testikulyar feminizasiya sindromu adı ilə tanınmışdır. 1953-cü ildə amerikalı ginekoloq Con Morris özünün iki xəstəsi də daxil olmaqla tibbi ədəbiyyatdan toplanmış 82 hadisə əsasında sindromun ilk tam təsvirini verdi.[2][52] Testislərin feminizasiya sindromu termini Morrisin xəstələrdə xayaların bədənə qadınlaşdırıcı təsir göstərən hormon istehsal etməsi fikrini əks etdirmək üçün seçilmişdir.[2] Hal-hazırda xəstəliyin səbəbi androgenlərin hərəkətsizliyi və sonradan testosteronun estrogenə çevrilməsi ilə əlaqələndirilir.[47][61] Morrisdən bir neçə il əvvəl Lavson Vilkins öz təcrübələri vasitəsilə hüceyrələrin androgen hormonlara həssaslığının "kişi psevdohermafroditizminə" səbəb olduğunu göstərdi. Vilkinsin təcrübələrində 46, XY genotipli qadınların androgenlərlə müalicə edildikdə terapevtik effektin olmadığını açıq şəkildə göstərdi. Xəstəliyin səbəbinin başa düşülməsindən sonra nomenklaturada "testicular feminisation syndrom" termini "androgen resistance" termini ilə əvəz edildi.[62]
Əsas mərhələlərin xronologiyası
[redaktə | mənbəni redaktə et]- 1950: Lavson Vilkins, virilizasiya əlamətləri göstərməyən 46, XY karyotipi olan bir xəstəyə metiltestosteron təyin etdi. Onun təcrübəsi androgen həssaslığını müalicə etmək üçün ilk sənədləşdirilmiş cəhddir.[47][63]
- 1970: Mary F. Lyon və Susan Havkes X xromosomunda bir genin siçanlarda tam androgen həssaslığına səbəb olduğunu bildirdi.
- 1981: Barbara Migeon və həmkarları insan androgen reseptorunun gen lokusunu (və ya androgen reseptor geninə nəzarət faktorunu) Xq11 və Xq13 arasında yerləşdirdilər.[64][65]
- 1988: İnsan androgen reseptor geni klonlaşdırıldı və ilk dəfə qismən analiz edildi. Terri Braun və həmkarları androgen həssaslığına səbəb olan ilk mutasiyaları bildirdilər.[66][67]
- 1989: Terri Braun və həmkarları dəqiq AR gen lokusunu tapdıqlarını bildirdilər (Xq11-Xq12). Dennis Luban və həmkarları onun ekson-intron sərhədlərini dərc etdilər.[14];[68]
- 1994: Androgen Reseptor Gen Mutasiyası Məlumat Bazası tibbi jurnallarda və konfrans materiallarında dərc olunan mutasiyaların hərtərəfli siyahısını saxlamaq üçün yaradıldı.[69]
Qədim terminologiya
[redaktə | mənbəni redaktə et]Androgen həssaslığının təsirlərinin ilk təsvirləri təcrid olunmuş hallar və ya interseks insanların fiziki xüsusiyyətlərinin hərtərəfli təsvirinin bir hissəsi kimi ortaya çıxdı.[70][71] 1839-cu ildə Şotlandiyalı mama-ginekoloq ser Ceyms Yanq Simpson interseks şərtləri ilə bağlı araşdırmada belə bir təsviri nəşr etdi.[72] Simpsonun taksonomiya sistemi isə əvvəlkindən çox fərqlənirdi. Taksonomiyalar və ya interseks variasiyaları təsnif etmək üçün təsvirlər 1549-cu ildə italyan həkimi və fiziki Fortune Affaitati,1573-cü ildə fransız cərrahı Ambroise Pare, fransız həkimi Nikolas Venette və 1832-ci ildə fransız zooloqu Isidore Geoffroy Saint-Hilaire tərəfindən hazırlanmışdı.[73][74] Bu müəlliflərin beşi də öz taksonomiyalarının əsası kimi danışıq dilində "hermafrodit" terminindən istifadə etmişdirlər.[75] Lakin, Simpson özü nəşrində bu sözün düzgünlüyünü şübhə altına almışdır. Tibb ədəbiyyatında "hermafrodit" sözünün istifadəsi bu günə qədər gəlib çatmışdır.[56][76][77][78][79]
Psevdohermafroditizm
[redaktə | mənbəni redaktə et]"Psevdohermafroditizm" termini indiki dövrə qədər tibbi ədəbiyyatda cinsiyyət vəziləri və karyotipi xarici cinsiyyət orqanına uyğun gəlməyən bir insanın vəziyyətini təsvir etmək üçün istifadə olunurdu.[75] Məsələn, karyotip 46, XY olan fərdlərdə qadın fenotipi və eyni zamanda yumurtalıqların yerinə testislər olur.[74][75] Kişi psevdohermafroditizmi yumurtalığa və xayaya (və ya ən azı bir yumurtalığı) sahib olan insanlara verilən adder. Tibb ədəbiyyatında bu sözün istifadəsi xromosomun kəşfindən əvvəl yaranmışdır. Ona görə də onun istifadəsi fərdin cinsini təyin edərkən karyotipi nəzərə almır. Əvvəlki "psevdohermafroditizm" tərifləri daxili və xarici orqanlar arasında ehtimal edilən uyğunsuzluqlara əsaslanırdı. Belə ki, fərdin "əsl" cinsini daxili orqanlar, "qavranılan" cinsini isə xarici orqanlar təyin edirdi.[70][72]
"Pseudohermaphrodite" sözünün tarixi və buna uyğun olaraq "əsl" hermafroditləri "yalançı" və ya "psevdo" hermafroditlərdən ayrılması 1709-cu ildə holland anatomu Frederik Ruysch tərəfindən testislər və diş ətləri olan bir mövzunu təsvir etmək üçün istifadə etdiyi vaxt işlədilmişdir.[80] "Pseudohermaphrodite" də həmin ilin sonunda Acta Eruditorum-da Ruysch işinin icmalında çıxdı. Həmçinin bəzi dəlillər göstərir ki, bu sözü Klebs istifadə etməzdən çox əvvəl Almaniya və Fransada tibb ictimaiyyəti artıq istifadə edirdi. Alman fizioloqu İohannes Peter Müller 1834-cü il nəşrində "psevdohermafroditizmi" Saint-Hilaire taksonomiyasından bir hermafroditizm alt sinfi ilə eyniləşdirdi və 1840-cı illərdə "psevdohermafroditizm" bir sıra fransız və alman nəşrlərində görünməyə başladı.
Testislərin feminizasiyası
[redaktə | mənbəni redaktə et]1953-cü ildə amerikalı ginekoloq Con Morris tibbi ədəbiyyatdan toplanmış 82 hadisə əsasında "testikulyar feminizasiya" adlandırdığı terminin ilk tam təsvirini verdi. "Xayaların feminizasiyası" termini Morrisin bu xəstələrdə xayaların bədənə qadınlaşdırıcı təsiri olan hormon istehsal etdiyinə dair müşahidəsini əks etdirmək üçün yaradılmışdır.[2][52][81] Morris məqaləsini dərc etməzdən bir neçə il əvvəl Lavson Vilkins eksperimental olaraq göstərmişdi ki, hüceyrənin androgen hormonların təsirinə cavab verməməsi "kişi psevdohermafroditizminin" olmasını göstərir.[2] 46, XY karyotipli qadınlara androgenlər verildikdə terapevtik faydanın olmadığını açıq şəkildə nümayiş etdirən Vilkinsin işi nomenklaturada "testikulyar feminizasiya" terminindən[47][61] "androgen müqaviməti" termininə tədricən keçidə səbəb oldu.[62]
Digər adlandırmaları
[redaktə | mənbəni redaktə et]Androgenə qarşı həssaslıq sindromu Reifenstein sindromu, Qoldberq-Maksvell sindromu (1948), Morris sindromu (1953), Gilbert-Dreyfus sindromu, Lube sindromu (1959), "natamam testis feminizasiyası" (1963), Rosewater sindromu (1965) və Ayman sindromu (1979) kimi adları ilə də tanınır.[82][47][83] Son 60 il ərzində, hətta eyni ailənin üzvləri arasında da təəccüblü dərəcədə fərqli fenotiplərin meydana gəldiyi bildirildiyi üçün və androgen həssaslığının əsas molekulyar patogenezini anlamaqda davamlı irəliləyiş əldə olunduğundan, bu şərtlərin fərqli fenotipik ifadələr olduğu aşkar edilmişdir.[2][13][47][83] Androgen həssaslığı ümumiyyətlə hüceyrələrin androgenik hormonların təsirinə cavab verməməsi nəticəsində yaranan vəziyyətlərin ümumi adıdır.[2][84] Tam androgen həssaslığına daha əvvəl "testikulyar feminizasiya", "Morris sindromu" və "Qoldberq-Maksvell sindromu" kimi təsvir edilən fenotiplər daxildir. Qismən androgen həssaslığına Reifenstein sindromu, Gilbert-Dreyfus sindromu, Lube sindromu, natamam testis feminizasiyası və Rosewater sindromu aid edilir. Yüngül androgen həssaslığına "Ayman sindromu" daxildir.[83][85][86]
Androgen həssaslığının daha virilləşmiş fenotipləri bəzən "az virilizasiya olunmuş kişi sindromu", "sonsuz kişi sindromu" və s. kimi təsvir edilmişdir.[87] Bu şərtlərin AR genindəki mutasiyalardan qaynaqlandığına dair sübutlar ortaya çıxmazdan əvvəl, bu diaqnozlar müxtəlif yüngül virilizasiya qüsurlarını təsvir etmək üçün istifadə olunurdu. Nəticədə diaqnoz qoyulan bəzi kişilərin fenotipləri qismən həssaslıq (məsələn, mikropenis, hipospadias və enməmiş testislər), digərləri isə yüngül həssaslıq (məsələn, təcrid olunmuş kişi sonsuzluğu və ya jinekomastiya) ilə daha yaxşı təsvir edilir.[2][32][33][86][88][89]
Mədəniyyətdə
[redaktə | mənbəni redaktə et]- "Orxideya" filmində hər iki personajda, Phoebe Hart və Bonnie Hartda bu sindrom vardır.[90]
- "Doktor Haus (teleserial, 2004)" seriyalının ikinci sezonunun 13-cü bölümündə bu sindrom təsvir edilmişdir.
- "None of the Above" kitabında baş qəhrəmanda bu xəstəlik vardır.[91]
- "XOXY, A Memoir: Intersex Woman, Mother, Activist" kitabında da Kimberli Zizelman bu mövzu haqqında öz fikirlərini qeyd etmişdir.[92]
İstinadlar
[redaktə | mənbəni redaktə et]- ↑ Эндокринология (2-е изд. Пер. с англ 10000 nüs.). М.: Практика. Под ред. Н. Лавина. 1999. 48–49. ISBN 5-89816-018-3.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Hughes I.A., Deeb A. Androgen resistance // Best Pract. Res. Clin. Endocrinol. Metab . 20 (naməlum dil). № 4. — 2006. dekabr. — 577—598. doi:10.1016/j.beem.2006.11.003. PMID 17161333.
- ↑ Stouffs K., Tournaye H., Liebaers I., Lissens W. Male infertility and the involvement of the X chromosome // Нп3 . 15 (journal) (ingilis). № 6. 2009. 623—637. doi:10.1093/humupd/dmp023. PMID 19515807.
- ↑ Zuccarello D., Ferlin A., Vinanzi C., Prana E., Garolla A., Callewaert L., Claessens F., Brinkmann A.O., Foresta C. Detailed functional studies on androgen receptor mild mutations demonstrate their association with male infertility // Clin. Endocrinol. (Oxf) . 68 (journal) (ingilis). № 4. — 2008. aprel. — 580—588. doi:10.1111/j.1365-2265.2007.03069.x. PMID 17970778.
- ↑ Ieuan A. Hughes, Asma Deeb. Androgen resistance // Best Practice & Research Clinical Endocrinology & Metabolism . 20 (4). 2006-12. 577—598. doi:10.1016/j.beem.2006.11.003. ISSN 1521-690X.
- ↑ 1 2 3 4 5 Angeliki Galani, Sophia Kitsiou-Tzeli, Christalena Sofokleous, Emmanuel Kanavakis, Ariadni Kalpini-Mavrou. Androgen insensitivity syndrome: clinical features and molecular defects // HORMONES . 7 (3). 2008-07-15. 217—229. doi:10.14310/horm.2002.1201. ISSN 1109-3099.
- ↑ D. Zuccarello, A. Ferlin, C. Vinanzi, E. Prana, A. Garolla. Detailed functional studies on androgen receptor mild mutations demonstrate their association with male infertility // Clinical Endocrinology . 68 (4). 2008-04. 580—588. doi:10.1111/j.1365-2265.2007.03069.x. ISSN 1365-2265 0300-0664, 1365-2265 (#bad_issn).
- ↑ 1 2 Alberto Ferlin, Cinzia Vinanzi, Andrea Garolla, Riccardo Selice, Daniela Zuccarello. Male infertility and androgen receptor gene mutations: clinical features and identification of seven novel mutations // Clinical Endocrinology . 65 (5). 2006-11. 606—610. doi:10.1111/j.1365-2265.2006.02635.x. ISSN 1365-2265 0300-0664, 1365-2265 (#bad_issn).
- ↑ K. Stouffs, H. Tournaye, I. Liebaers, W. Lissens. Male infertility and the involvement of the X chromosome // Human Reproduction Update . 15 (6). 2009-06-10. 623—637. doi:10.1093/humupd/dmp023. ISSN 1460-2369 1355-4786, 1460-2369 (#bad_issn).
- ↑ 1 2 Tamer Özülker, Tevfik Özpaçacı, Filiz Özülker, Ümit Özekici, Remziye Bilgiç. Incidental detection of Sertoli–Leydig cell tumor by FDG PET/CT imaging in a patient with androgen insensitivity syndrome // Annals of Nuclear Medicine . 24 (1). 2009-12-04. 35—39. doi:10.1007/s12149-009-0321-x. ISSN 1864-6433 0914-7187, 1864-6433 (#bad_issn).
- ↑ Carol A. Davis-Dao, Ellenie D. Tuazon, Rebecca Z. Sokol, Victoria K. Cortessis. Male Infertility and Variation in CAG Repeat Length in the Androgen Receptor Gene: A Meta-analysis // The Journal of Clinical Endocrinology & Metabolism . 92 (11). 2007-11-01. 4319—4326. doi:10.1210/jc.2007-1110. ISSN 1945-7197 0021-972X, 1945-7197 (#bad_issn).
- ↑ Hisaya Kawate, Yin Wu, Keizo Ohnaka, Rong-Hua Tao, Kei-ichiro Nakamura. Impaired Nuclear Translocation, Nuclear Matrix Targeting, and Intranuclear Mobility of Mutant Androgen Receptors Carrying Amino Acid Substitutions in the Deoxyribonucleic Acid-Binding Domain Derived from Androgen Insensitivity Syndrome Patients // The Journal of Clinical Endocrinology & Metabolism . 90 (11). 2005-11. 6162—6169. doi:10.1210/jc.2005-0179. ISSN 1945-7197 0021-972X, 1945-7197 (#bad_issn).
- ↑ 1 2 3 4 Bruce Gottlieb, Rose Lombroso, Lenore K Beitel, Mark A Trifiro. Molecular pathology of the androgen receptor in male (in)fertility // Reproductive BioMedicine Online . 10 (1). 2005-01. 42—48. doi:10.1016/s1472-6483(10)60802-4. ISSN 1472-6483.
- ↑ 1 2 C J Brown, S J Goss, D B Lubahn, D R Joseph, E M Wilson. Androgen receptor locus on the human X chromosome: regional localization to Xq11-12 and description of a DNA polymorphism. // American Journal of Human Genetics . 44 (2). 1989-2. 264—269. ISSN 0002-9297. 2021-03-10 tarixində arxivləşdirilib.
- ↑ Bruce Gottlieb, Lenore K. Beitel, Mark A. Trifiro. Variable expressivity and mutation databases: The androgen receptor gene mutations database // Human Mutation . 17 (5). 2001. 382—388. doi:10.1002/humu.1113. ISSN 1098-1004 1059-7794, 1098-1004 (#bad_issn).
- ↑ Birgit Köhler, Serge Lumbroso, Juliane Leger, Francoise Audran, Enric Sarret Grau. Androgen Insensitivity Syndrome: Somatic Mosaicism of the Androgen Receptor in Seven Families and Consequences for Sex Assignment and Genetic Counseling // The Journal of Clinical Endocrinology & Metabolism . 90 (1). 2005-01. 106—111. doi:10.1210/jc.2004-0462. ISSN 1945-7197 0021-972X, 1945-7197 (#bad_issn).
- ↑ Olaf Hiort, Gernot H.G. Sinnecker, Paul-Martin Holterhus, Esther Maria Nitsche, Klaus Kruse. Inherited and de novo androgen receptor gene mutations: Investigation of single-case families // The Journal of Pediatrics . 132 (6). 1998-06. 939—943. doi:10.1016/s0022-3476(98)70387-7. ISSN 0022-3476.
- ↑ J. A. Batch, D. M. Williams, H. R. Davies, B. D. Brown, B. A. J. Evans. Androgen receptor gene mutations identified by SSCP in fourteen subjects with androgen insensitivity syndrome // Нп3 . 1 (7). Oxford University Press. 1992. 497—503. doi:10.1093/hmg/1.7.497. ISSN 1460-2083 0964-6906, 1460-2083 (#bad_issn).
- ↑ Olaf Hiort, George Klauber, Mare Cendron, Gernot H. G. Sinnecker, Lutz Keim. Molecular characterization of the androgen receptor gene in boys with hypospadias // European Journal of Pediatrics . 153 (5). 1994-05. 317—321. doi:10.1007/bf01956409. ISSN 1432-1076 0340-6199, 1432-1076 (#bad_issn).
- ↑ Jianming Lu, Mark Danielsen. A Stu I polymorphism in the human androgen receptor gene (AR) // Clinical Genetics . 49 (6). 2008-06-28. 323—324. doi:10.1111/j.1399-0004.1996.tb03800.x. ISSN 1399-0004 0009-9163, 1399-0004 (#bad_issn).
- ↑ D. Hamer, S Hu, V. Magnuson, N Hu, A. Pattatucci. A linkage between DNA markers on the X chromosome and male sexual orientation // Science . 261 (ingilis) (5119). 1993-07-16. 321—327. doi:10.1126/science.8332896. ISSN 1095-9203 0036-8075, 1095-9203 (#bad_issn).
- ↑ Bruce Gottlieb, Denise M. Vasiliou, Rose Lumbroso, Lenore K. Beitel, Leonard Pinsky. <527::aid-humu12>3.0.co;2-x Analysis of exon 1 mutations in the androgen receptor gene // Human Mutation . 14 (6). 1999-12. 527—539. doi:10.1002/(sici)1098-1004(199912)14:6<527::aid-humu12>3.0.co;2-x. ISSN 1098-1004 1059-7794, 1098-1004 (#bad_issn).
- ↑ Karla F. S. Melo, Berenice B. Mendonca, Ana Elisa C. Billerbeck, Elaine M. F. Costa, Marlene Inácio. Clinical, Hormonal, Behavioral, and Genetic Characteristics of Androgen Insensitivity Syndrome in a Brazilian Cohort: Five Novel Mutations in the Androgen Receptor Gene // The Journal of Clinical Endocrinology & Metabolism . 88 (7). 2003-07. 3241—3250. doi:10.1210/jc.2002-021658. ISSN 1945-7197 0021-972X, 1945-7197 (#bad_issn).
- ↑ S. F. Ahmed, A. Cheng, L. Dovey, J. R. Hawkins, H. Martin. Phenotypic Features, Androgen Receptor Binding, and Mutational Analysis in 278 Clinical Cases Reported as Androgen Insensitivity Syndrome1 // The Journal of Clinical Endocrinology & Metabolism . 85 (2). 2000-02. 658—665. doi:10.1210/jcem.85.2.6337. ISSN 1945-7197 0021-972X, 1945-7197 (#bad_issn).
- ↑ Régis Coutant, Delphine Mallet, Najiba Lahlou, Natacha Bouhours-Nouet, Agnès Guichet. Heterozygous Mutation of Steroidogenic Factor-1 in 46,XY Subjects May Mimic Partial Androgen Insensitivity Syndrome // The Journal of Clinical Endocrinology & Metabolism . 92 (8). 2007-08. 2868—2873. doi:10.1210/jc.2007-0024. ISSN 1945-7197 0021-972X, 1945-7197 (#bad_issn).
- ↑ Masahiro Adachi, Ryoichi Takayanagi, Arihiro Tomura, Kyosuke Imasaki, Shigeaki Kato. Androgen-Insensitivity Syndrome as a Possible Coactivator Disease // New England Journal of Medicine . 343 (12). 2000-09-21. 856—862. doi:10.1056/nejm200009213431205. ISSN 1533-4406 0028-4793, 1533-4406 (#bad_issn).
- ↑ Farid J. Ghadessy, Joyce Lim, Abdullah A.R. Abdullah, Valerie Panet-Raymond, Chee Keong Choo. Oligospermic infertility associated with an androgen receptor mutation that disrupts interdomain and coactivator (TIF2) interactions // Journal of Clinical Investigation . 103 (11). 1999-06-01. 1517—1525. doi:10.1172/jci4289. ISSN 0021-9738.
- ↑ Yvonne L. Giwercman, Sten A. Ivarsson, Jonas Richthoff, Kristina B. Lundin, Aleksander Giwercman. A Novel Mutation in the D-Box of the Androgen Receptor Gene (S597R) in Two Unrelated Individuals Is Associated with both Normal Phenotype and Severe PAIS // Hormone Research in Paediatrics . 61 (2). 2004. 58—62. doi:10.1159/000075240. ISSN 1663-2826 1663-2818, 1663-2826 (#bad_issn).
- ↑ 1 2 Yvonne Lundberg Giwercman, Agneta Nordenskjöld, E. Martin Ritzén, Karl Olof Nilsson, Sten-A. Ivarsson. An Androgen Receptor Gene Mutation (E653K) in a Family with Congenital Adrenal Hyperplasia due to Steroid 21-Hydroxylase Deficiency as well as in Partial Androgen Insensitivity // The Journal of Clinical Endocrinology & Metabolism . 87 (6). 2002-06. 2623—2628. doi:10.1210/jcem.87.6.8518. ISSN 1945-7197 0021-972X, 1945-7197 (#bad_issn).
- ↑ Leonard Pinsky, Morris Kaufman, Donald W. Killinger, John M. Opitz, James F. Reynolds. Impaired spermatogenesis is not an obligate expression of receptor-defective androgen resistance // American Journal of Medical Genetics . 32 (1). 1989-01. 100—104. doi:10.1002/ajmg.1320320121. ISSN 1096-8628 0148-7299, 1096-8628 (#bad_issn).
- ↑ PLACIDO B. GRINO, JAMES E. GRIFFIN, WILLIAM G. CUSHARD, JEAN D. WILSON. A Mutation of the Androgen Receptor Associated with Partial Androgen Resistance, Familial Gynecomastia, and Fertility* // The Journal of Clinical Endocrinology & Metabolism . 66 (4). 1988-04. 754—761. doi:10.1210/jcem-66-4-754. ISSN 1945-7197 0021-972X, 1945-7197 (#bad_issn).
- ↑ 1 2 T Tsukada, M Inoue, S Tachibana, Y Nakai, H Takebe. An androgen receptor mutation causing androgen resistance in undervirilized male syndrome. // The Journal of Clinical Endocrinology & Metabolism . 79 (4). 1994-10. 1202—1207. doi:10.1210/jcem.79.4.7962294. ISSN 1945-7197 0021-972X, 1945-7197 (#bad_issn).
- ↑ 1 2 Aleksander Giwercman, Thomas Kledal, Marianne Schwartz, Yvonne Lundberg Giwercman, Henrik Leffers. Preserved Male Fertility Despite Decreased Androgen Sensitivity Caused by a Mutation in the Ligand-Binding Domain of the Androgen Receptor Gene1 // The Journal of Clinical Endocrinology & Metabolism . 85 (6). 2000-06. 2253—2259. doi:10.1210/jcem.85.6.6626. ISSN 1945-7197 0021-972X, 1945-7197 (#bad_issn).
- ↑ E.L. Yong, S.C. Ng, A.C. Roy, G. Yun, S.S. Ratnam. Pregnancy after hormonal correction of severe spermatogenic defect due to mutation in androgen receptor gene // The Lancet . 344 (ingilis) (8925). Elsevier. 1994-09. 826—827. doi:10.1016/s0140-6736(94)92385-x. ISSN 0140-6736.
- ↑ 1 2 3 L. V. Belousov. Scott F. Gilbert—Developmental Biology, 2010, Sinauer Associates, Inc., Sunderland, MA Ninth Edition // Russian Journal of Developmental Biology . 42 (5). 2011-09. 349—349. doi:10.1134/s1062360411050043. ISSN 1608-3326 1062-3604, 1608-3326 (#bad_issn). 2018-06-02 tarixində arxivləşdirilib.
- ↑ 1 2 3 4 5 6 Richard E. Jones, Kristin H. Lopez. Sexual Differentiation // Human Reproductive Biology. Elsevier. 2006. 127—148. ISBN 9780120884650.
- ↑ 1 2 3 E.L. Yong. Androgen receptor gene and male infertility // Human Reproduction Update . 9 (1). 2003-01-01. 1—7. doi:10.1093/humupd/dmg003. ISSN 1460-2369 1355-4786, 1460-2369 (#bad_issn).
- ↑ Sabine E. Hannema, Ian S. Scott, John Hodapp, Howard Martin, Nick Coleman. Residual Activity of Mutant Androgen Receptors Explains Wolffian Duct Development in the Complete Androgen Insensitivity Syndrome // The Journal of Clinical Endocrinology & Metabolism . 89 (11). 2004-11. 5815—5822. doi:10.1210/jc.2004-0709. ISSN 1945-7197 0021-972X, 1945-7197 (#bad_issn).
- ↑ 1 2 Meghan B. Oakes, Aimee D. Eyvazzadeh, Elisabeth Quint, Yolanda R. Smith. Complete Androgen Insensitivity Syndrome—A Review // Journal of Pediatric and Adolescent Gynecology . 21 (6). 2008-12. 305—310. doi:10.1016/j.jpag.2007.09.006. ISSN 1083-3188.
- ↑ A.K. Roy, Y. Lavrovsky, C.S. Song, S. Chen, M.H. Jung. Regulation of Androgen Action // Vitamins & Hormones. Elsevier. 1998. 309—352. ISBN 9780127098555.
- ↑ John M. Kokontis, Shutsung Liao. Molecular Action of Androgen in the Normal and Neoplastic Prostate // Vitamins & Hormones. Elsevier. 1998. 219—307. ISBN 9780127098555.
- ↑ Singh Rajender, Nalini J. Gupta, Baidyanath Chakrabarty, Lalji Singh, Kumarasamy Thangaraj. Ala 586 Asp mutation in androgen receptor disrupts transactivation function without affecting androgen binding // Fertility and Sterility . 91 (3). 2009-03. 933.e23—933.e28. doi:10.1016/j.fertnstert.2008.10.041. ISSN 0015-0282.
- ↑ Qi Wang, Farid J. Ghadessy, Alan Trounson, David de Kretser, Rob McLachlan. Azoospermia Associated with a Mutation in the Ligand-Binding Domain of an Androgen Receptor Displaying Normal Ligand Binding, but DefectiveTrans-Activation1 // The Journal of Clinical Endocrinology & Metabolism . 83 (12). 1998-12. 4303—4309. doi:10.1210/jcem.83.12.5358. ISSN 1945-7197 0021-972X, 1945-7197 (#bad_issn).
- ↑ Annastiina Lund, Vesa Juvonen, Jaana Lähdetie, Kristiina Aittomäki, Juha S Tapanainen. A novel sequence variation in the transactivation regulating domain of the androgen receptor in two infertile Finnish men // Fertility and Sterility . 79. 2003-06. 1647—1648. doi:10.1016/s0015-0282(03)00256-5. ISSN 0015-0282.
- ↑ Roberto Casella, Maria Rosa Maduro, Larry I Lipshultz, Dolores J Lamb. Significance of the polyglutamine tract polymorphism in the androgen receptor // Urology . 58 (5). 2001-11. 651—656. doi:10.1016/s0090-4295(01)01401-7. ISSN 0090-4295.
- ↑ Статья|автор=D. L. Stenoien, C. J. Cummings, H. P. Adams, M. G. Mancini, K. Patel |год=1999-05-01 |doi=10.1093/hmg/8.5.731 |issn=0964–6906, 1460–2083 |выпуск=5 |страницы=731–741 |издание=Нп3|Human Molecular Genetics |заглавие=Polyglutamine-Expanded Androgen Receptors Form Aggregates That Sequester Heat Shock Proteins, Proteasome Components and SRC-1, and Are Suppressed by the HDJ-2 Chaperone |ссылка=http://dx.doi.org/10.1093/hmg/8.5.731 |том=8 |издательство=Oxford University Press
- ↑ 1 2 3 4 5 6 Gregorio Pérez-Palacios, Bertha Chávez, Juan Pablo Méndez, Julianne Imperato McGinley, Alfredo Ulloa-Aguirre. The syndromes of androgen resistance revisited // Journal of Steroid Biochemistry . 27 (4—6). 1987-01. 1101—1108. doi:10.1016/0022-4731(87)90196-8. ISSN 0022-4731.
- ↑ I. S. Ismail-Pratt, M. Bikoo, L.-M. Liao, G. S. Conway, S. M. Creighton. Normalization of the vagina by dilator treatment alone in Complete Androgen Insensitivity Syndrome and Mayer-Rokitansky-Kuster-Hauser Syndrome // Human Reproduction . 22 (7). 2007-07-01. 2020—2024. doi:10.1093/humrep/dem074. ISSN 1460-2350 0268-1161, 1460-2350 (#bad_issn).
- ↑ Evans, B Hughes, I Bevan, C Patterson, M Gregory, J. Phenotypic diversity in siblings with partial androgen insensitivity syndrome. BMJ Group. 1997-06.
- ↑ Jennifer L. Nichols, Eric J. Bieber, Jennifer S. Gell. Case of sisters with complete androgen insensitivity syndrome and discordant Müllerian remnants // Fertility and Sterility . 91 (3). 2009-03. 932.e15—932.e18. doi:10.1016/j.fertnstert.2008.09.027. ISSN 0015-0282.
- ↑ SE Hannema, IS Scott, E Rajpert-De Meyts, NE Skakkebæk, N Coleman. Testicular development in the complete androgen insensitivity syndrome // The Journal of Pathology . 208 (4). 2006. 518—527. doi:10.1002/path.1890. ISSN 1096-9896 0022-3417, 1096-9896 (#bad_issn).
- ↑ 1 2 3 Quigley C.A., De Bellis A., Marschke K.B., el-Awady M.K., Wilson E.M., French F.S. Androgen receptor defects: historical, clinical, and molecular perspectives // Нп3 . 16 (journal) (ingilis). № 3. Нп3. — 1995. iyun. — 271—321. doi:10.1210/edrv-16-3-271. PMID 7671849.
- ↑ Wolfgang Weidemann, Birgit Linck, Heike Haupt, Birgit Mentrup, Gabriela Romalo. Clinical and biochemical investigations and molecular analysis of subjects with mutations in the androgen receptor gene // Clinical Endocrinology . 45 (6). 1996-12. 733—739. doi:10.1046/j.1365-2265.1996.8600869.x. ISSN 1365-2265 0300-0664, 1365-2265 (#bad_issn).
- ↑ A. Deeb, J. Jääskeläinen, M. Dattani, H. C. Whitaker, C. Costigan. A Novel Mutation in the Human Androgen Receptor Suggests a Regulatory Role for the Hinge Region in Amino-Terminal and Carboxy-Terminal Interactions // The Journal of Clinical Endocrinology & Metabolism . 93 (10). 2008-10. 3691—3696. doi:10.1210/jc.2008-0737. ISSN 1945-7197 0021-972X, 1945-7197 (#bad_issn).
- ↑ ELISABETH H. QUINT, JENIFER D. McCARTHY, YOLANDA R. SMITH. Vaginal Surgery for Congenital Anomalies // Clinical Obstetrics and Gynecology . 53 (1). 2010-03. 115—124. doi:10.1097/grf.0b013e3181cd4128. ISSN 0009-9201.
- ↑ 1 2 Ieuan A. Hughes. Disorders of sex development: a new definition and classification // Best Practice & Research Clinical Endocrinology & Metabolism . 22 (1). 2008-02. 119—134. doi:10.1016/j.beem.2007.11.001. ISSN 1521-690X.
- ↑ Kyu-Rae Kim, Youngmee Kwon, Jae Young Joung, Kun Suk Kim, Alberto G. Ayala. True Hermaphroditism and Mixed Gonadal Dysgenesis in Young Children: A Clinicopathologic Study of 10 Cases // Modern Pathology . 15 (10). 2002-10. 1013—1019. doi:10.1097/01.mp.0000027623.23885.0d. ISSN 1530-0285 0893-3952, 1530-0285 (#bad_issn).
- ↑
- ↑ Annemie L. M. Boehmer, Hennie Brüggenwirth, Cissy van Assendelft, Barto J. Otten, Marja C. T. Verleun-Mooijman. GenotypeVersusPhenotype in Families with Androgen Insensitivity Syndrome // The Journal of Clinical Endocrinology & Metabolism . 86 (9). 2001-09. 4151—4160. doi:10.1210/jcem.86.9.7825. ISSN 1945-7197 0021-972X, 1945-7197 (#bad_issn).
- ↑ I. Mazen, M. El-Ruby, R. Kamal, I. El-Nekhely, M. El-Ghandour. Screening of Genital Anomalies in Newborns and Infants in Two Egyptian Governorates // Hormone Research in Paediatrics . 73 (6). 2010. 438—442. doi:10.1159/000313588. ISSN 1663-2818 1663-2826, 1663-2818 (#bad_issn).
- ↑ 1 2 Wilkins L. Heterosexual development. In: The diagnosis and treatment of endocrine disorders in childhood and adolescence. Springfield, IL: Charles C Thomas, 1950, pp. 256–279.
- ↑ 1 2 Oakes M.B., Eyvazzadeh A.D., Quint E., Smith Y.R. Complete androgen insensitivity syndrome--a review // Şablon:Нп3 . 21 (journal) (ingilis). № 6. — 2008. dekabr. — 305—310. doi:10.1016/j.jpag.2007.09.006. PMID 19064222.
- ↑ THE DIAGNOSIS AND TREATMENT OF ENDOCRINE DISORDERS IN CHILDHOOD AND ADOLESCENCETHE DIAGNOSIS AND TREATMENT OF ENDOCRINE DISORDERS IN CHILDHOOD AND ADOLESCENCE. By WilkinsLawson, Associate Professor of Pediatrics, The Johns Hopkins University, Baltimore. Charles C Thomas, Publisher, Springfield, Illinois, xx+408 pp., 411 illustrations, 6 in color. $13.00. // Endocrinology . 47 (5). 1950-11. 391—391. doi:10.1210/endo-47-5-391. ISSN 1945-7170 0013-7227, 1945-7170 (#bad_issn).
- ↑ MARY F. LYON, SUSAN G. HAWKES. X-linked Gene for Testicular Feminization in the Mouse // Nature . 227 (ingilis) (5264). 1970-09. 1217—1219. doi:10.1038/2271217a0. ISSN 1476-4687 0028-0836, 1476-4687 (#bad_issn).
- ↑ Susumu Ohno, Mary F. Lyon. X-Linked testicular feminization in the mouse as a non-inducible regulatory mutation of the Jacob-Monod type // Clinical Genetics . 1 (3—4). 1970-07. 121—127. doi:10.1111/j.1399-0004.1970.tb01627.x. ISSN 0009-9163.
- ↑ B. R. Migeon, T. R. Brown, J. Axelman, C. J. Migeon. Studies of the locus for androgen receptor: localization on the human X chromosome and evidence for homology with the Tfm locus in the mouse. // Proceedings of the National Academy of Sciences . 78 (ingilis) (10). Национальная академия наук США. 1981-10-01. 6339—6343. doi:10.1073/pnas.78.10.6339. ISSN 1091-6490 0027-8424, 1091-6490 (#bad_issn).
- ↑ T. R. Brown, D. B. Lubahn, E. M. Wilson, D. R. Joseph, F. S. French. Deletion of the steroid-binding domain of the human androgen receptor gene in one family with complete androgen insensitivity syndrome: evidence for further genetic heterogeneity in this syndrome. // Proceedings of the National Academy of Sciences . 85 (ingilis) (21). Национальная академия наук США. 1988-11-01. 8151—8155. doi:10.1073/pnas.85.21.8151. ISSN 1091-6490 0027-8424, 1091-6490 (#bad_issn).
- ↑ D. B. Lubahn, T. R. Brown, J. A. Simental, H. N. Higgs, C. J. Migeon. Sequence of the intron/exon junctions of the coding region of the human androgen receptor gene and identification of a point mutation in a family with complete androgen insensitivity. // Proceedings of the National Academy of Sciences . 86 (ingilis) (23). Национальная академия наук США. 1989-12-01. 9534—9538. doi:10.1073/pnas.86.23.9534. ISSN 1091-6490 0027-8424, 1091-6490 (#bad_issn).
- ↑ B Gottlieb. The androgen receptor gene mutations database // Nucleic Acids Research . 24 (1). 1996-01-01. 151—154. doi:10.1093/nar/24.1.151. ISSN 1362-4962.
- ↑ 1 2 Robert Bentley Todd. The cyclopædia of anatomy and physiology. Ed. by Robert B. Todd ... London,: Sherwood, Gilbert, and Piper,. 1836.
- ↑ Helen King. Midwifery, Obstetrics and the Rise of Gynaecology. 2017-03-02. doi:10.4324/9781315248981.
- ↑ 1 2 Isidore. Geoffroy Saint Hilaire. Histoire générale et particulière des anomalies de l'organisation chez l'homme et les animaux. Paris :: J.B. Baillière,. 1832.
- ↑ Faith Y. Dorsey, Michael H. Hsieh, David R. Roth. 46,XX SRY-Negative True Hermaphrodite Siblings // Urology . 73 (3). 2009-03. 529—531. doi:10.1016/j.urology.2008.09.050. ISSN 0090-4295.
- ↑ 1 2 G. Verkauskas, F. Jaubert, S. Lortat-Jacob, V. Malan, E. Thibaud. The Long-Term Followup of 33 Cases of True Hermaphroditism: A 40-Year Experience With Conservative Gonadal Surgery // Journal of Urology . 177 (2). 2007-02. 726—731. doi:10.1016/j.juro.2006.10.003. ISSN 1527-3792 0022-5347, 1527-3792 (#bad_issn).
- ↑ 1 2 3 I.A. Hughes, C. Houk, S.F. Ahmed, P.A. Lee. Consensus statement on management of intersex disorders // Journal of Pediatric Urology . 2 (3). 2006-06. 148—162. doi:10.1016/j.jpurol.2006.03.004. ISSN 1477-5131. 2019-12-10 tarixində arxivləşdirilib.
- ↑ M Simmonds. Was "variations of reproductive development" considered? // Archives of Disease in Childhood . 92 (1). 2007-01-01. 89—89. doi:10.1136/adc.2006.107797. ISSN 1468-2044 0003-9888, 1468-2044 (#bad_issn).
- ↑ Gian Franco Zannoni, Valerio Gaetano Vellone, Emanuela Lucci Cordisco, Eugenio Sangiorgi, Maria Eufemia Grimaldi. Morphology and Immunophenotyping of a Monolateral Ovotestis in a 46,XderY/45,X Mosaic Individual With Ambiguous Genitalia // International Journal of Gynecological Pathology . 29 (1). 2010-01. 33—38. doi:10.1097/pgp.0b013e3181b52e75. ISSN 0277-1691.
- ↑ Ellen K. Feder, Katrina Karkazis. What's in a Name?: The Controversy over "Disorders of Sex Development" // Hastings Center Report . 38 (5). 2008. 33—36. doi:10.1353/hcr.0.0062. ISSN 1552-146X.
- ↑ Elizabeth. Reis. Divergence or Disorder?: the politics of naming intersex // Perspectives in Biology and Medicine . 50 (4). 2007. 535—543. doi:10.1353/pbm.2007.0054. ISSN 1529-8795.
- ↑ August Lucae. Handbuch der pathologischen Anatomie von Prof. Dr. E. Klebs. // Archiv für Pathologische Anatomie und Physiologie und für Klinische Medicin . 72 (2). 1878-02. 288—288. doi:10.1007/bf01878774. ISSN 1432-2307 0945-6317, 1432-2307 (#bad_issn).
- ↑ John McLean Morris. The syndrome of testicular feminization in male pseudohermaphrodites // American Journal of Obstetrics and Gynecology . 65 (6). 1953-06. 1192—1211. doi:10.1016/0002-9378(53)90359-7. ISSN 0002-9378.
- ↑ Reifenstein EC Jr. (1947). "Hereditary familial hypogonadism". Proc Am Fed Clin Res. 3: 86.
- ↑ 1 2 3 Simpson JL (2008). "Male Pseudohermaphroditism Due to Androgen Insensitivity or 5α-Reductase Deficiency". Glob. Libr. Women's Med. The Global Library of Women's Medicine.
- ↑ Hester JD (2004). "Intersex(e) und alternative Heilungsstrategien — Medizin, soziale Imperative und identitatsstiftende Gegengemeinschaften". Ethik Med. 16: 48–67.
- ↑ Michael J McPhaul. Molecular defects of the androgen receptor // The Journal of Steroid Biochemistry and Molecular Biology . 69 (1—6). 1999-04. 315—322. doi:10.1016/s0960-0760(99)00050-3. ISSN 0960-0760.
- ↑ 1 2 Hoff TA, Fuqua SA (2000). "Steroid and nuclear receptor polymorphism variants in hormone resistance and hormone independence". In Miller MS, Cronin MT (eds.). Genetic polymorphisms and susceptibility to disease. Washington, DC: Taylor & Francis. p. 111
- ↑ Charles Sultan, Serge Lumbroso, Françoise Paris, Claire Jeandel, B. Terouanne. Disorders of Androgen Action // Seminars in Reproductive Medicine . 20 (3). 2002. 217—228. doi:10.1055/s-2002-35386. ISSN 1526-4564 1526-8004, 1526-4564 (#bad_issn).
- ↑ Jianhua Chu, Rongmei Zhang, Zhimin Zhao, Wei Zou, Yefei Han. Male Fertility Is Compatible with an Arg840Cys Substitution in the AR in a Large Chinese Family Affected with Divergent Phenotypes of AR Insensitivity Syndrome // The Journal of Clinical Endocrinology & Metabolism . 87 (1). 2002-01. 347—351. doi:10.1210/jcem.87.1.8167. ISSN 1945-7197 0021-972X, 1945-7197 (#bad_issn).
- ↑ D Meschede. The molecular genetics of male infertility // Molecular Human Reproduction . 3 (5). 1997-05-01. 419—430. doi:10.1093/molehr/3.5.419. ISSN 1460-2407.
- ↑ Hart, Phoebe, producer, director, cinematographer. Hart, Bonnie, cinematographer. Milton, Vanessa, editor. Rippingale, Simon, animator. Connor, Biddy, composer. Patterson, David, composer. "Orchids : my intersex adventure". İstifadə tarixi: 2019-05-03.
- ↑ Gregorio, I. W., 1976-. None of the above (First edition). New York, NY. ISBN 0-06-233531-6, 978-0-06-233531-9, 978-0-06-233532-6, 0-06-233532-4.
- ↑ Zieselman, Kimberly M.,. XOXY : a memoir (intersex woman, mother, activist). Philadelphia, PA. ISBN 978-1-78450-990-3, 1-78450-990-6.
Keçidlər
[redaktə | mənbəni redaktə et]- www.indiana.edu — англоязычный сайт, посвящённый СНкА и схожим нарушениям
- http://www.medterms.com/script/main/art.asp?articlekey=14430
- http://www.hawaii.edu/PCSS/biblio/articles/2000to2004/2004-ais-and-klinefelters.html
![İnsan embrionunun hansı cinsə mənsub olduğu inkişafın yeddinci həftəsinə qədər bilinmir[35].](https://upload.wikimedia.org/wikipedia/commons/7/77/Human_sexual_differentiation.gif)
![Kişi cinsiyyət orqanlarının maskulinləşməsi həm testosteron, həm də dihidrotestosterondan asılıdır.[35].](https://upload.wikimedia.org/wikipedia/commons/thumb/7/72/Androgen_dependencies_of_male_genital_tissues.png/300px-Androgen_dependencies_of_male_genital_tissues.png)