
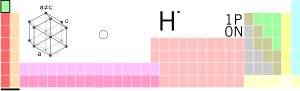







...tibdə və biologiyada tətbiqi”. // Tərkibində hidrogen olan. Hidrogen birləşmələri. – Kimyəvi saf su iki kimyəvi ünsür əmələ gətirir. Bunlardan biri y
Tam oxu »...(химический элемент, легкий газ, образующий в соединении с кислородом воду). Hidrogen-peroksid перекись водорода II прил. 1. водородный (имеющий в св
Tam oxu »








[yun. hydor və genos-doğma] водород (кислороддихъ галаз акахьдамаз яд арадал гъидай кьезил газ; химиядин элемент); // водороддин
Tam oxu »ру газообразный водород en gaseous hydrogen de gasförmiger Wasserstoff fr hydrogène gazeux es hidrógeno gaseoso it idrogeno gassoso
Tam oxu »ру производство водорода en hydrogen generation de Wasserstofferzeugung fr génération d'hydrogène es generación de hidrógeno it generazione d'idrogeno
Tam oxu »ру фторид водорода en hydrogen fluoride de Fluorwasserstoff fr hydrogène fluoré es hidrógeno fluorado it idrogeno fluorato
Tam oxu »[yun. hydor və phone – səs] Suda yayılan və ya əmələ gələn səs dalğalarını tutmaq üçün cihaz
Tam oxu »сущ. гидрофон (прибор для приема звуковых волн, распространяющихся или возникающих в воде)
Tam oxu »[yun. hydor və phone-səs] гидрофон (цин къене чкӀизвай ва я арадал къвезвай ванцин лепеяр кьун патал прибор).
Tam oxu »...– выращиванию растений без грунта, на питательных искусственных средах). Hidroponik istixanalar гидропонные теплицы, hidroponik becərmə üsulu гидропо
Tam oxu »...(не смачивающееся водой). Hidrofob örtük гидрофобное покрытие, hidrofob sement гидрофобный цемент
Tam oxu »su ilə islanmayan örtüklər – metalları korroziyadan qorumaq, başqa materiallara islanmaq keyfiyyəti verməmək üçün istifadə edilir
Tam oxu »-а; м. (от греч. hýdōr - вода и phōn'ē - звук, голос) Прибор для приёма звуковых волн, возникающих, распространяющихся в воде.
Tam oxu »(hidro…+..yun. ponos-iş) bitkilərin süni mühitdə, torpaqsız becərilməsi. Bu zaman bitkinin kök sistemi bərk substrat (qida əhəmiyyəti olmayan) üzərind
Tam oxu »