Fruktozo-2,6-bisfosfat
Bu məqaləni vikiləşdirmək lazımdır. |
Fruktozo-2,6-bisfosfat (fruktozo-2,6-difosfat, Fr-2,6-F, Fru-2,6-P2) –fosfofruktokinazlar 1(FFK-1) və fruktozo-1,6-bisfosfatazlar (FBFаза-1) — qlükozanı gücləndirir və qlükogenezlərin2 qarşısını alır. Fosfat turşusunun efirlərindən və fruktozadan ibarətdir. Bitkilərdə və heyvanlarda Fr-2,6-F-in sintezi və parçalanması, fosfofruktokinazoy-2/fruktozo-2,6-bisfosfatozoy-2-nin –iki aktiv mərkəzi2 olan bifunksional fermenti ilə həyata keçirilir. Bir molekula AТF-dən istifadə etməklə fruktoza-6-fosfatı fosforlaşdırmaq yolu ilə əmələ gələn Fr-2,6-F, sonradan deqradasiya nəticəsində fruktozo- 6-fosfata və Fн[4][5] ayrılır.
Kəşf olunma tarixi
[redaktə | mənbəni redaktə et]Fruktozo-2,6-bisfosfat, Qardenin laboratoriyasında Yanq tərəfindən ilk dəfə olaraq mayadan fruktozanın ikiqat efirinin və fosfat turşusunun ayrılmasından 71 il sonra kəşf olunmuş və fruktozo-1,6-bisfosfat6kimi identifikasiya olunmuşdur. 1979-cu ildə dörd qrup tədqiqatçı tərəfindən bildirilmişdir ki, qlükon hormonunun iştirakı ilə inkubasiya olunmuş hepatositlərdə fosfofruktokinaz-1 fermentinin aktivliyinin zəifləməsi baş verir. 1980-ci ildə Emil Van Şaftingen və əməkdaşları7 göstərmişdir ki, gel filtrləmə və ya fermentin təmizlənməsi zamanı effekt yoxa çıxır. Onlar sonra müəyyən etmişlər ki, fosfofruktokinaz-1 aktivliyini gücləndirilməsinə nail olmaq üçün sadəcə qara ciyərin ekstraktının ultramərkəzdənqaçma prosesi zamanı alınan aşağı molekullu fraksiyaya hepatotsiata əlavə etmək kifayətdir. Bu fraksiyadan ayrılan aşağı molekullu stimulyator tədqiqatçılar tərəfindən fruktozo-2,6-bisfosfat8 kimi eyniləşdirilmişdir.
Heyvanlarda qlükozanın metabolizminə təsiri
[redaktə | mənbəni redaktə et]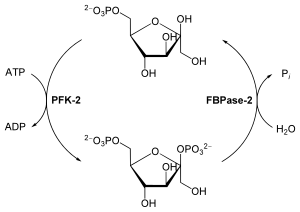
Fruktozo-2,6-bisfosfatın sintezi və parçalanması
[redaktə | mənbəni redaktə et]Fruktozo-2,6-bisfosfat, fosfofruktokinaz-1 allestrik aktivləşdirməklə qlükozanın parçalanmasını stimullaşdırır. Məsələn, qara ciyərdə Fr-2,6-F yüksək qatılıqda olması FFK-1 aktivləşdirməklə fruktozo-2,6-bisfosfata oxşarlığını artırır və onun inhibitor — АТF və tsitrata bilavasitə bənzəməsini azaldır. FFК-1 özünün fizioloji qatılığında tamamilə qeyri-aktivdir, lakin Fr-2,6-F-lə qarşılıqlı təsirdə olduqda fermenti aktiv formaya çevirir və qlikolizi2 stimullaşdırır. Bununla yanaşı fruktozo-2,6-bisfosfat, parçalanmaya qarşı inhibitor kimi təsir göstərərək, yaranan fruktozo-1,6-bisfosfat-ın parçalanmasının qarşısını alır. Belə ki, Fr-2,6-F qlikoliz və qlükoneogenaz proseslərinin eyni zamanda getməsinə imkan vermir. Əks təqdirdə qlükozanın daima piruvata və sonra isə yenidən qlükozaya çevrilməsi kimi faydasız tsiklik proseslərin yaranması prosesi baş verə bilərdi. Toxumalarda Fr-2,6-F-in səviyyəsi, onun FFК-2/FBFaza-2 fermentindən sintezi və parçalanması yolu ilə requlyasiya olunur. Bu prosesdə əsas rolu fosforilləşdirmə/defosforilləşdirmə fermenti ilə birgə qarşılıqlı təsirdə olan insulin, qlükaqon və adrenalin hormonları oynayır. Belə ki, qlükaqon qara ciyərdə olan adenilatsiklazanı aktivləşdirir və tsАMF-in sintezi prosesi başlayır, hansı ki, bu da öz növbəsində tsАМF-asılı proteinkinazları aktivləşdirir. Bu kinaz FFК-2/FBFaz-2-nin serin qalığının N-ucunu fosforilləşdirir, bununla da fruktoza-2,6-bisfosfatazın aktivliyini stimullaşdırmaqla fosfofruktokinaz-2 kimi fəaliyyətinin qarşısını alır. Hüceyrədə Fr-2,6-F-in səviyyəsi aşağı düşür. Fr-2,6-F-in səviyyəsinin aşağı olması şəraitində qlikoliz zəifləyir, qlükoneogenez isə, əksinə, sürətlənir. Insulin geriyə dönüş prosesini başladır. Onun qatılığını artırdıqda, tsАMF-in səviyyəsi azalır, bu da öz növbəsində, proteinfosfatazanın aktivliyini artırır, FFК-2/FBFaza-2-ni defosforilləşdirir, fruktoza-2,6-bisfosfatazın aktivliyinin qarşısını alaraq fosforfruktokinaz-2-ni aktivləşdirir. Beləliklə, Fr-2,6-F səviyyəsinin artırılması FFК-1 fermentini aktivləşdirir və qlükoneogenezi4,9,10 ləngidərək, qlikolizi stimullaşdırır.
Göbələklərdə qlükozanın metabolizminə təsiri
[redaktə | mənbəni redaktə et]Fruktozo-2,6-bisfosfatın göbələklərə təsiri bütövlükdə heyvanlarla analojidir: onun qatılığının artması qlikolizi stimullaşdırır və qlükoneogenezi zəiflədir. Bir qisim göbələklərdə Fr-2,6-F-in sintezinə səbəb olan ferment, tsАМF və АТF-in səviyyəsinə qarşı həssas deyil. Bunun əvəzinə, FFК-2/FBF-2-nin requlyasiyası əsas substratın – fruktozo-6-fosfatın səviyyəsi və karbonun mənbəsinin ümumi miqdarına görə həyata keçirilir. Başqa qisim göbələklərdə, o cümlədən maya göbələklərində, əksinə, FFК-2/FBF-2-nin tsАМF–dən asılı tənzimlənmə yolu mövcuddur və onun fosfofruktokinaz aktivliyi isə АТF-lə13,14 yüksək səviyyədə qarşısı alınır. Ümumiyyətlə, bütün göbələklər üçün Fr-2,6-F səviyyəsinin hansısa ümumi requlyasiya mexanizmini göstərmək mümkün olmur. Belə ki, bütün bunlar göbələyin həyat tərzindən və yerləşdiyi ekoloji mühitdən çox asılıdır. Bitkilərdə saxarozanın sintezinin tənzimlənməsi Heyvanlardan fərqli olaraq bitkilərdə, fruktozo-2,6-fosfat АТF- asılı fosfofruktokinaz 1-ə təsir etmir, amma pirofosfat-asılı fosfofruktokinazı dəqiq şəkildə stimullaşdırır, hansı ki, qeyri-üzvi pirofosfat və fosfotazlara15 inhibitor kimi təsir etməklə fruktozo-6-fosfatı fosforilləşdirir. Fr-2,6-F Kelvin tsiklinin son məhsulu olan triozofosfatların səviyyəsinin requlyasiyasında vacib rol oynayır. Saxarozanın sintezinin əsas substratı olan fruktozo-6-fosfatın əmələ gəlməsinin inhibitorudur. İntensiv fotosintez zamanı triozofosfatların (qliseraldehid-3-fosfat və 3-fosforqliseratın) daimi yaranması baş verir, FFK-2/FB faza-2 ilə allosterik qarşılıqlı təsirdə olur, fruktozo-2,6-bisfosfatın sintezinə inhibitor kimi təsir edir (ləngidir), bununla da saxarozanın əmələ gəlməsini stimullaşdırır. Fr-2,6-F qaranlıqda — fotosintez proseslərinin getmədiyi və triozofosfatların yaranması dayandığı zaman sintez olunmağa başlayır. Bitkilərdə bu proses qeyri-üzvi fosfatla və fruktozo-6-fosfatla16 allosterik olaraq aktivləşdir. Beləliklə, tənzimləyici molekulun sintezi mürəkkəb şəkildə bitki hüceyrələrində C6/C3 şəkərlərinin nisbətindən asılı olur. Bu nisbətə saxarozanın sintezinin intensivliyi və trioozofosfat15 əvəzinə xloroplastların Fн-ə nəql edilməsinə aktiv təsir edəcək.
Mənbə
[redaktə | mənbəni redaktə et]- Биологическая химия с упражнениями и задачами / Под ред. С. Е. Северина. — М.: Издательская группа "ГЭОТАР-Медиа", 2011. — С. 95. — 624 с.
- Lange AJ. fructose-2,6-bisphosphate. UniversityofMinnesota.
- Wu C, Khan SA, Peng LJ, Lange AJ (2006). "Roles for fructose-2,6-bisphosphate in the control of fuel metabolism: beyond its allosteric effects on glycolytic and gluconeogenic enzymes". Adv. EnzymeRegul. 46 (1): 72–88. DOI:10.1016/j.advenzreg.2006.01.010. PMID 16860376.
- Kurland IJ, Pilkis SJ (June 1995). "Covalent control of 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase: insights into autoregulation of a bifunctional enzyme". ProteinSci. 4 (6): 1023–37. DOI:10.1002/pro.5560040601. PMID 7549867.
- Michels P. A., Rigden D. J. Evolutionary analysis of fructose 2,6-bisphosphate metabolism. (англ.) // IUBMB life. — 2006. — Vol. 58, no. 3. — P. 133–141. — DOI:10.1080/15216540600688280. — PMID 16766380. [исправить]
- Selected Topics in the History of Biochemistry: Personal Recollections (page 77)
- Van Schaftingen, L. Hue, and H. G. Hers (1980 Dec 15). "Fructose 2,6-bisphosphate, the probably structure of the glucose- and glucagon-sensitive stimulator of phosphofructokinase.". Biochem J. 192 (3): 897–901.
- H. G. Hers and E. Van Schaftingen (1982 Jul 15). "Fructose 2,6-bisphosphate 2 yearsafteritsdiscovery.". Biochem J. 206 (1): 1–12.
- Smith WE, Langer S, Wu C, Baltrusch S, Okar DA (June 2007). "Molecular coordination of hepatic glucose metabolism by the 6-phosphofructo-2-kinase/fructose-2,6 — bisphosphatase:glucokinase complex". Mol. Endocrinol. 21 (6): 1478–87. DOI:10.1210/me.2006–0356. PMID 17374851.
- Нельсон, Кокс, 2014, с. 144–146.
- JoséAbrahãoNeto (June 1993). "Characterization of phosphofructokinase II and regulation of fructose 2,6-bisphosphate levels in Trichodermareesei". Microbiology 139: 1363–1369. DOI:10.1099/00221287-139-6-1363.
- Vandercammen A1, François JM, Torres BB, Maia JC, Hers HG (Jan 1990). "Fructose 2,6-bisphosphate and carbohydrate metabolism during the life cycle of the aquatic fungus Blastocladiellaemersonii.". J GenMicrobiol 136 (1): 137–46. PMID 2161899.
- Gandhi Radis-BaptistaDavid N, Urquizo Valdivia, José Abrahão-Neto (January 2011). "Fructose 2,6-bisphosphate biosynthesis and regulation of carbohydrate metabolism in Aspergillusoryzae". CanadianJournalofMicrobiology 44 (1): 6–11. DOI:10.1139/w97–129.
- Dihazi H1, Kessler R, Eschrich K. (2003 may 27). "Glucose-induced stimulation of the Ras-cAMP pathway in yeast leads to multiple phosphorylations and activation of 6-phosphofructo-2-kinase.". Biochemistry 42 (20): 6275–6282. DOI:10.1021/bi034167r. PMID 12755632.
- Ермаков, 2005, с. 223.
- Nielsen TH, Rung JH, Villadsen D (November 2004). "Fructose-2,6-bisphosphate: a traffic signal in plant metabolism". Trends Plant Sci. 9 (11): 556–63. DOI:10.1016/j.tplants.2004.09.004. PMID 15501181.