Katalaza
Bu məqaləyə hansısa kateqoriya əlavə edilməmişdir. Məqaləyə kateqoriyalar əlavə edərək töhfə verə bilərsiz. |
Bu məqaləni vikiləşdirmək lazımdır. |
Katalaza — hidrogen- peroksidi (H2O2) dihidrogen (H2) və dihidrogen- monooksidə (H2O, su) parçalayan enzim (ferment)[1]. Tərkibində Fe3+ kationu saxlayır. Bu günə qədər hidrogen peroksidi katalaza enzimindən sürətli parçalayan katalizator nə tapılmış, nə də sintez edilməmişdir. Hidrogen peroksidlə əmələ gətirdiyi aralıq kompleks katalaza peroksidat (CAT-H2O2) adlanır. Tənəffüs zamanı ağ ciyərlərimizdə hidrogen- peroksid alınır. Bu maddə tibdə istifadə edilməsinə baxmayaraq zəhərlidir. Bu səbəbdən orqanizmdə katalaza enziminə (fermentinə)ehtiyac olur. Katalaza demək olar ki, bütün aerob orqanizmlərdə tapılmışdır. Katalaza dörd subvahiddən əmələ gəlmişdir və tərkibində təxminən 2 milyon aminturşu qalığı mövcuddur, yəni tetramerdir[2] . Bu dörd subvahiddə hidrogen- peroksidlə reaksiyaya daxil olmağa imkan verən hem var. İnsan orqanizmində katalaza üçün optimal pH=7-dir[3] pH- ın 6.8 və 7.5 kimi qiymətlərində reaksiya getmir..[4]. Digər orqanizmlər üçün bu qiymət 6–11 arası qiymətlər alır[5] . Optimal tamperatur isə müxtəlif orqanizmlər üçün müxtəlifdir.[6] .
| Katalaza | |
|---|---|
 | |
| Ümumi | |
| Sistematik adı | Katalaza |
| Kimyəvi formulu | CAT kimi işarə olunur |
| Fiziki xassələri | |
| Aqreqat halı (n.ş.) | maye |
| Quruluşu | |
| Koordinasiya həndəsəsi | qarışıq formalı |
| Təsnifatı | |
| CAS-da qeyd. nöm. | 9001-05-2 |
| BS-də qeydiyyat nömrəsi | 1.11.1.6 |
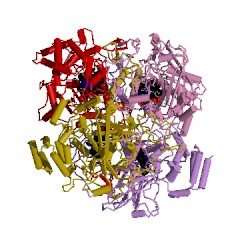
Quruluşu
[redaktə | mənbəni redaktə et]İnsan katalazasını konseptual dörd bölməyə bölmək olar ki, bu dörd bölmə birlikdə tetramer təşkil edir[7]. Hər qlobulada geniş hidrofob əsaslı 8 antiparalel b-barel vardır (b1–8) və bir tərəfdən A9 loops ilə əhatə olunmuşdur[7].b-barel üzərindəki A Helikal domayn b4 və b5 qalıqları arasında əldə olunan dörd C-terminal Helices (A16, A17, A18 və A19) və dörd Helicesdən ibarətdir (A4, A5, A6, və a7)[7].
Tarixi
[redaktə | mənbəni redaktə et]1818-ci ildə Louis Jacques Thenard səhvən hidrogen peroksidi parçalayan enzim tapır. Bu enzim katalaza idi. Bu enzim sonradan bir çox orqanizmlərdə tapıldı və Oscar Loew 1900-cü ildə bu enzimi katalaza adlandırmağı təklif etdi[8]
İstinadlar
[redaktə | mənbəni redaktə et]- ↑ Chelikani P, Fita I, Loewen PC. "Diversity of structures and properties among catalases". Cellular and Molecular Life Sciences. 61 (2). January 2004: 192–208. doi:10.1007/s00018-003-3206-5. PMID 14745498.
- ↑ Boon EM, Downs A, Marcey D. "Catalase: H2O2: H2O2 Oxidoreductase". Catalase Structural Tutorial Text. 2019-10-22 tarixində arxivləşdirilib. İstifadə tarixi: 2007-02-11.
- ↑ Maehly AC, Chance B. "The assay of catalases and peroxidases". Methods of Biochemical Analysis. Methods of Biochemical Analysis. 1. 1954: 357–424. doi:10.1002/9780470110171.ch14. ISBN 978-0-470-11017-1. PMID 13193536.
- ↑ Aebi H. "Catalase in vitro". Methods in Enzymology. Methods in Enzymology. 105. 1984: 121–6. doi:10.1016/S0076-6879(84)05016-3. ISBN 978-0-12-182005-3. PMID 6727660.
- ↑ "EC 1.11.1.6 - catalase". BRENDA: The Comprehensive Enzyme Information System. Department of Bioinformatics and Biochemistry, Technische Universität Braunschweig. 2013-11-03 tarixində arxivləşdirilib. İstifadə tarixi: 2009-05-26.
- ↑ Toner K, Sojka G, Ellis R. "A Quantitative Enzyme Study; CATALASE". bucknell.edu. 2000-06-12 tarixində arxivləşdirilib. İstifadə tarixi: 2007-02-11.
- ↑ 1 2 3 Putnam CD, Arvai AS, Bourne Y, Tainer JA. "Active and inhibited human catalase structures: ligand and NADPH binding and catalytic mechanism". Journal of Molecular Biology. 296 (1). February 2000: 295–309. doi:10.1006/jmbi.1999.3458. PMID 10656833.
- ↑ Loew O. "A New Enzyme of General Occurrence in Organisms". Science. 11 (279). May 1900: 701–2. Bibcode:1900Sci....11..701L. doi:10.1126/science.11.279.701. JSTOR 1625707. PMID 17751716.