Kompleks birləşmələr
Bu məqaləyə hansısa kateqoriya əlavə edilməmişdir. Məqaləyə kateqoriyalar əlavə edərək töhfə verə bilərsiz. |
Kompleks birləşmələr- (lat. complexus — kombinasiya, birlikdə) yəni kimyəvi reaksiyalarda atomun əsas valentlikləri ilə yanaşı, müəyyən şəraitdə əlavə valentliklərdə meydana çıxa bilər.
Koordinasion birləşmələr
[redaktə | mənbəni redaktə et]
Koordinasion quruluşa malik olan maddələr koordinasion birləşmələr adlanır. Onların kristal qəfəsində verilmiş maddənin ayrıca molekulları olmur, qəfəsdə yerləşən hər bir atom (ion) müəyyən sayda bərabər məsafədə və eyni tipli kimyəvi rabitə ilə (ion, kovalent, metal) əlaqələnən qonşu hissəciklərlə (atom, ion) əhatə olunmuşdur. Koordinasion birləşmələr məhlula keçdikdə tərkib hissələrinə ayrılmırsa, belə koordinasion birləşmələr kompleks birləşmələr hesab edilir. . Mündəricat
Kompleks birləşmələrin yaranma tarixi
[redaktə | mənbəni redaktə et]
Kompleks birləşmələr haqqında ideyaları kimya elminə gətirən və onun nəzəri əsasını qoyan İsveçrə alimi Alfred Verner(1983 –cü il) olmuşdur. Onun koordinasion birləşmələr sahəsindəki elmi nailiyyətləri yüksək qiymətləndirilmiş və o, 1913 –cü ildə Nobel mükafatına layiq görülmüşdür. Kompleks birləşmələr kimyasının inkişafında rus alimi L. A. Çuqayev və onun çox saylı şagirdləri -İ. İ. Çernyayev, A. A. Qrinberq, V. V. Lebedinskinin, sonralar N.Q.Klyuçnikov, E.B.Qlikina və başqalarının rolu böyükdür.
Kompleks birləşmələrin alınması
[redaktə | mənbəni redaktə et]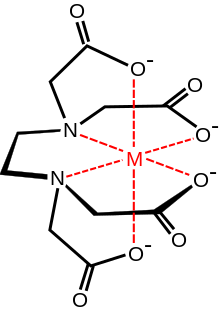
Bütün birləşmələr kimi kompleks birləşmələrin alınması bir çox amillərdən asılıdır. Bunlardan mühitin pH –nı, temperaturu, vaxtı, həlledicinin növünü və oksidləşdirici və ya reduksiyaediciliyini, katalizatorun təsirini, götürülmüş komponentlərin qatılığını və s. göstərmək olar. Kompleksin əmələgəlməsinin əsas səbəbi ion –ion, ion –molekul, molekul –molekul arasında həm elektrostatik , həm də donor –akseptor qarşılıqlı təsirinin olmasıdır.
Kompleks birləşmələr kimyasının əsas anlayışları
[redaktə | mənbəni redaktə et]Koordinasion birləşmələr kimyasında tədqiq edilən əsas sahə, mərkəzi hissəcik və onun ətrafında koordinasiya edən liqandlardan təşkil olunmuş molekul və ionlardır. Koordinasiya nəzəriyyəsindən məlumdur ki, kompleks birləşmələr daxili və xarici sferadan ibarətdir. Kompleks birləşmənin dissosasiya xarakterini, həmçinin kimyəvi reaksiyaya daxil olmasını öyrənməklə kompleksdəki rabitələrin təbiətini müəyyən etmək olur. Liqandlar kompleks əmələgətirici ilə donor –akseptor koordinativ rabitə əmələ gətirirlər. Liqandlar mərkəzi atoma ikimərkəzli σ –, π –və δ–rabitələri ilə və çox mərkəzli rabitələrlə birləşirlər. İkimərkəzli mərkəzi atom –liqand σ –rabitəsi metal kationunun boş orbitalı ilə liqandın donor atomunun bölünməmiş elektron cütünün ümumiləşməsi hesabına donor –akseptor mexanizmi əsasında yaranır. Liqandlar σ –elektron donoru olmaqla yanaşı, eyni zamanda π –elektronlarının akseptoru da olurlar. π –rabitə metal kationunun bölünməmiş elektron cütünün donoru və liqand atomunun boş orbitalının akseptoru hesabına donor –akseptor mexanizmi ilə yaranır. Bunların əmələgəlmə mexanizminə növbəti bölmələrdə baxılacaq. Beləliklə, kompleks birləşmələrdə liqandlar mərkəzi atoma koordinasiya edir. Kompleks birləşmənin mərkəzi atomuna (hissəsinə) koordinasiya edən atomların və ya atom qruplarının sayı koordinasiya ədədi adlanır. Əgər mərkəzi atom –liqand rabitəsi ikimərkəzlidirsə onda, koordinasiya ədədi mərkəzi atomda yaranan σ –rabitələrin sayına bərabərdir. Məsələn, ionunda 4σ –rabitə olduğundan koordinasiya ədədi dördə bərabərdir.Kompleks birləşmədə koordinativ rabitə əmələgətirən liqand atomlarının sayı, başqa sözlə koordinasiya sferasında liqandın tutduğu yerin sayı həmin liqandın dentantlığı (koordinasiya tutumu) adlanır. “Dentant” latın sözü olub, mənası “dişli” deməkdir. Ümumiyyətlə, liqandın tərkibində olan bir və ya bir neçə atom kompleks əmələgətirici ilə eyni zamanda birbaşa rabitə əmələgətirə bilər. Belə atomların miqdarından asılı olaraq onlar monodentant və polidentant liqandlara ayrılır. Monodentant liqandlarda yalnız bir atom donor kimi istifadə edilir və bir koordinasiya yeri tutur. Məsələn, su molekulunda yalnız oksigen atomu bölünməmiş elektron cütünün donoru kimi mərkəzi atomla birləşir. Su molekulunda yalnız bir oksigen atomu olduğundan o, yalnız monodentant ola bilir. Koordinasiya ədədi. Əvvəllər koordinasion birləşmələrdə valentlik münasibətlərini xarakterizə etmək üçün bir ümumi “valentlik” terminindən istifadə edilirdi. O, bir tərəfdən atomlar arasındakı kovalent rabitələrin sayını göstərmək üçün, digər tərəfdən isə oksidləşmə dərəcəsinin sinonimi kimi tətbiq edilirdi. Bu çoxmənalılıq çox zaman bir –birinə zidd fikirlər yaratdığı üçün “valentlik” termini rədd edildi. Məsələn, , , , birləşmələrində metal atomları onları əhatə edən liqandlarla bir neçə kovalent rabitə əmələgətirdiyi halda onlar sıfır valentli hesab edilirdi.Hazırda valentlik münasibəti daha dəqiq koordinasiya ədədi, kovalentlik və oksidləşmə dərəcəsi terminləri ilə xarakterizə olunur. Atomun özünə birləşdirdiyi atom və ya atom qruplarının sayı koordinasiya ədədi adlanır. Koordinasiya ədədi rabitənin tipindən (birqat, ikiqat və ya üçqat), həmçinin rabitənin lokallaşmasından və ya delokallaşmasından asılı deyil. Məsələn, və ionlarında borun koordinasiya ədədi 4, karbonunki isə üçdür. Koordinasiya ədədi kompleks əmələgətiricinin (mərkəzi atomun) oksidləşmə dərəcəsindən böyük olur və 1, 2, 3, 4, 5, 6, 7, 8, 9, 12 koordinasiya ədədi məlumdur. Kompleks birləşmədə mərkəzi metal atomunun koordinasiya ədədi metalın oksidləşmə dərəcəsi ilə əlaqəli deyildir. Mərkəzi ionun oksidləşmə dərəcəsi (elektromənfiliyi) liqandların formal yüklərinin cəmi ilə kompleks hissəciyin (ionun) yükünün fərqinə bərabərdir.
Kompleks birləşmələrin təsnifatı
[redaktə | mənbəni redaktə et]Kompleks birləşmələrin tərkibi, quruluşu və xassələri çox müxtəlif olur. Buna görə də onların təsnifatı müxtəlif əlamətlərə əsasən verilə bilər. Daxili sferanın yükünün xarakterinə görə kompleks birləşmələr üç qrupa ayrılır:
- Kation kompleks birləşmələrdə daxili sfera müsbət yüklü olur. Həmin kation müsbət yüklü kompleksəməgətiricidən və polyar molekulalardan təşkil olunur. Məsələn, akva komplekslər və aminatlar – kation komplekslərdir. Liqandları yalnız H2O-dan ibarət olan komplekslər akva komplekslər və ya hidratlar adlanır. ; ; və başqaları akva komplekslərə misal ola bilər. Liqandları dən təşkil olunmuş komplekslər amminatlar (və ya amin komplekslər) adlanır. Məs, ; ; və s.
- Anion kompleks birləşmələrdə daxili sfera mənfi yüklü olur. Bu növ kompleks birləşmələrdə kompleksəmələgətirici həm müsbət metal, həm də müsbət qeyri-metal ionları ola bilər. Liqandlar isə, bir qayda olaraq, anionlardan ibarət olur. Məsələn: ; ; ; ; və s.
- Neytral kompleks birləşmələr birsferalı komplekslərdir. Liqandların yüklərinin cəmi kompleksəmələgətiricinin yükünə qiymətcə bərabər, işarəcə əks olduqda elektroneytral kompleks əmələ gəlir. Belə komplekslər həm yüksüz, həm də yüklü liqandlar və kompleksəmələgətiricilərdən təşkil oluna bilər. Aşağıdakı komplekslər neytral komplekslərə misal ola bilər. ; ; ; ;.
Kompleks birləşmələrdə izomeriya
[redaktə | mənbəni redaktə et]İzomeriya kompleks birləşmələrin kimyasında geniş yayılmış hadisədir. Bu hadisə eyni kimyəvi tərkibli maddələrin müxtəlif quruluşa və beləliklə də müxtəlif xassələrə malik olması ilə əlaqədardır. Kompleks birləşmələrdə izomeriyanın öyrənilməsi və inkişaf etdirilməsi sahəsində L.A.Çuqayevin tələbələri olan İ.İ.Çernyayev, A.A.Qrinberq və B.B.Lebedinski xüsusi rol oynamışlar. kompleks birləşmələrin izomeriyasının müxtəlif növləri məlumdur.
Həndəsi izomeriya
[redaktə | mənbəni redaktə et]Bu növ izomeriya liqandların daxili sferada bir-birinə görə müxtəlif vəziyyətdə yerləşdiyi zaman müşahidə olunur. Həm də izomerlərin miqdarı, başqa sözlə liqandların yerləşmə variantlarının sayı bir tərəfdən kompleks birləşmənin quruluşundan, digər tərəfdən isə müxtəlif liqandların miqdarından asılıdır.
İzomeriya kompleks birləşmələrin kimyasında geniş yayılmış hadisədir.
Optiki izomeriya
[redaktə | mənbəni redaktə et]Belə izomerlər bir-birindən optik aktivliklərinə görə fərqlənir. İşığın polyarizasiya müstəvisini fırlatma qabiliyyətinə malik birləşmələr optik aktiv birləşmələr adlanır. Optik izomerlərdən biri bu müstəvini sağa, o biri isə sola fırladır. Optik izomeriya asimmetrik, yəni heç bir simmetriya müstəvisi olmayan molekullarda müşahidə olunur. Optik izomeriyanı ilk dəfə 1921-ci ildə Verner müşahidə etmişdir.
Kompleks birləşmələrdə rəngin əmələgəlməsi
[redaktə | mənbəni redaktə et]Kompleks birləşmələrin rəngi liqandın növündən və kompleksəmələgətiricidən asılıdır. Kompelksəmələgətiricinin energetik səviyyəsinin şaxələnməsi haqqında təsəvvürlər kompleks birləşmənin maqnit xassəsi ilə yanaşı onların rəngini –optiki xassələrini izah etməyə imkan verir. Rəngin yaranması d-elektronları ilə sıx bağlıdır .
| FeII | FeIII | CoII | CuII | AlIII | CrIII | |
|---|---|---|---|---|---|---|
| Hidratlaşmış ion | [Fe(H2O)6]2+ Açıq-yaşıl |
[Fe(H2O)6]3+ Sarımtıl-qəhvəyi |
[Co(H2O)6]2+ Çəhrayı |
[Cu(H2O)6]2+ Boz-mavi |
[Al(H2O)6]3+ Rengsiz |
[Cr(H2O)6]3+ Açıq-yaşıl |
| OH-, durulaşmış məhlul | [Fe(H2O)4(OH)2] Açıq-yaşıl |
[Fe(H2O)3(OH)3] Qəhvəyi |
[Co(H2O)4(OH)2] Mavi |
[Cu(H2O)4(OH)2] Göy |
[Al(H2O)3(OH)3] Ağ |
[Cr(H2O)3(OH)3] Yaşıl |
| OH-, qatılaşmış məhlul | [Fe(H2O)4(OH)2] Açıq-yaşıl |
[Fe(H2O)3(OH)3] Qəhvəyi |
|[Co(H2O)4(OH)2] Mavi |
[Cu(H2O)4(OH)2] Göy |
[Al(OH)4]- Rengsiz |
[Cr(OH)6]3- Açıq-yaşıl |
| NH3, durulaşmış məhlul | [Fe(H2O)4(OH)2] Açıq-yaşıl< |
[Fe(H2O)3(OH)3] Qəhvəyi |
[Co(H2O)4(OH)2] Mavi |
[Cu(H2O)4(OH)2] Göy |
[Al(H2O)3(OH)3] Ağ |
[Cr(H2O)3(OH)3] Yaşıl |
| NH3, qatılaşmış məhlul | [Fe(H2O)4(OH)2] Açıq-yaşıl |
[Fe(H2O)3(OH)3] Qəhvəyi |
[Co(NH3)6]2+ Sarı |
[Cu(NH3)4(H2O)2]2+| Tünd -göy |
[Al(H2O)3(OH)3] Ağ |
[Cr(NH3)6]3+ Açıq-yaşıl |
| CO32- | FeCO3 Açıq-yaşıl |
[Fe(H2O)3(OH)3] Qəhvəyi |
CoCO3 Çəhrayı |
CuCO3 Mavi |
Kompleks birləşmələrin adlandırılması
[redaktə | mənbəni redaktə et]Koordinasiya nəzəriyyəsinin kəşfinə qədər kompleks birləşmələrin adlandırılmasında heç bir sistemlik yox idi. Beləki, kompleks birləşmələr onları sintez edən alimin adına və ya rənginə görə adlandırılırdı. Bir çox kompleks birləşmələr hazırkı dövrə qədər öz tarixi adını saxlamışdır. Məsələn, Kossun birinci duzu -, Kossun ikinci duzu -, Reyneke duzu –, Fişer duzu –Yaşıl rəngli -kobalttrazeoxlorid, Qırmızı rəngli - -kobaltrozeoxlorid və s. Çox sayda kompleks birləşmələr sintez edildikcə, onların belə adlandırılması qənaətləndirici deyildir. Buna görə də kompleks birləşmələrin adlandırılmasında müəyyən sistematiklik lazım idi. İlk rasional adlandırılma qaydasını koordinasiya nəzəriyyəsinin əsasını qoyan Verner vermişdir. Vernerin təklif etdiyi adlandırılma çox az dəyişikliklərlə hal –hazırda tətbiq edilir. 1953 –cü ildə Beynəlxalq nəzəri və tətbiqi kimyaçılar ittifaqının (İUPAC) qeyri –üzvi birləşmələrin adlandırılması komissiyası tərəfindən qeyri –üzvi birləşmələri adlandırmaq üçün nümunəvi layihə hazırlanmışdır. Bu layihəyə əsaslanaraq qeyri –üzvi, o cümlədən kompleks birləşmələrin milli nomenklaturası yaradıldı və bu Verner nomenklaturasından cüzi fərqlənir.Bütün səmərəli adlandırmada olduğu kimi, kompleks birləşmələrin adlandırılmasında da birinci kation sonra isə anionun adının deyilməsi prinsipi əsas götürülür. Kompleks ionun tərkibinin adlandırılmasında müvafiq qaydalar rəhbər götürülür:
- Anion –liqandın adının sonuna “o” şəkilçisi əlavə edilir. (xloro -, sulfato -, oksalato -). Radikal kimi (metil -, fenil -) baxılan liqandın adları müstəsnalıq təşkil edir, olduğu kimi adlanır. Neytral liqandların adına şəkilçi əlavə edilmir. liqandı ammin, –akvo adlanır.
- Kompleks ionunun tərkibində bir neçə müxtəlif neytral molekul olarsa, onlar aşağıdakı ardıcıllıqla sadalanır: a) birinci molekulu –ammin deyilir. b) ikinci ammonyakın törəmələri: –hidrazin, –metilamin, –etilamin, –piridin, – etilendiamin və s. deyilir.
- Koordinasiya olunmuş qrupların sayı yunanca 1 –mono, 2 –di, 3 –tri, 4 –tetra, 5 –penta, 6 –heksa söz önləri ilə göstərilir. Əgər liqand mürəkkəbdirsə, onda bis -, tris -, tetrakis –sözönlərindən istifadə edilir. Liqandın sayı bir olduqda çox vaxt mono sözü işlədilmir.
- Kompleks hissəciyi adlandırarkən birinci növbədə liqand anion, liqand –molekul sadalanır, sonra isə mərkəzi atom deyilir. Kompleks ionun formulunda isə verilmiş ardıcıllıq tərsinə sıra ilə yazılır. İUPAC (İnternational Union of Pure and Chemistry) sisteminə görə mərkəzi atomun oksidləşmə dərəcəsi hissəciyin adından sonra mötərizədə roma rəqəmi ilə işarə edilir.Beləliklə, birləşməsi xloropentaammin kobalt (III) xlorid adlanır. Burada mono –sözönü buraxılmışdır. Əgər kompleks hissəcik anion tiplidirsə, onda onun adının sonuna “at” şəkilçisi əlavə edilir. Məsələn, birləşməsi kalium –tetrasiano nikelat adlanır. Reyneke duzu adlanan birləşməsini ammonium -tetrarodanodiamminxromat (III) adlandırmaq lazımdır. SCN-anion –liqandı kükürd atomu vasitəsilə mərkəzi atoma koordinasiya etdikdə rodanit və ya tiosianat adlanır və formulda məsələn, - kimi göstərilir. Azot atomu ilə koordinasiya edirsə, onda izorodanid (izotiosianat) adlanır və bəzən də təsadüf hallarda formulda kimi göstərilir. İUPAC nomenklaturasında kompleks birləşmələrin çoxsaylı rasional və praktiki adları da mövcuddur. ionunun duzları rənglərinə görə: luteo –duzu, rozeo –duzu, prazeo –duzu və s. adlanır.
Kompleks birləşmələrin davamlılığı
[redaktə | mənbəni redaktə et]Kompleks birləşmələrin davamlılığı müxtəlif olur. davamlılıq dərəcəsindən asılı olaraq kompleks birləşmələr müxtəlif cür dissosiasiya edir. Davamlı kompleks birləşmələrin dissosiasiya prosesi adətən kompleks ionun əmələ gəlməsi ilə məhdudlaşır. Yəni kompleks ion çox cüzi dərəcədə dissosiasiya edir. Davamlılığı kifayət dərəcədə olmayan kompleks birləşmələrin kompleks ionları da öz növbəsində dissosiasiya uğrayır. Məsələn, kifayət dərəcədə davamlıdır. Onun dissosiasiyası aşağıdakı kimi gedir:
↔2K+ + [PtCl6]2-
isə az davamlıdır. Buna görə də o məhlulda birinci haldan fərqli olaraq, sadə ionlara qədər dissosiasiya edir:
↔ 2+ + Cl2
2+ ↔2+ + 4NH3
Kompleks ion tam şəkildə dissosiasiyaya uğramırsa, həmin proses kütlələrin təsiri qanununa tabe olur. Bu halda kompleks ionun qatılığı sərbəst liqandlar və kompleksəmələgətirici arasında asılılıq dissosiasiya sabiti ilə müəyyən edilir. Bu sabit əslində kompleks ionun davamsızlığını xarakterizə etdiyi üçün o, adətən davamsızlıq sabiti adlanır.
Daxili kompleks birləşmələr
[redaktə | mənbəni redaktə et]Kompleksəmələgəlmə prosesində mürəkkəb üzvi liqandlar iştirak etdikdə, adi liqandlardan fərqli olaraq, onların tərkibində olan əsasi atomlardan (azot, kükürd, oksigen və s.) bir neçəsi mərkəzi atomla koordinasiya edir. Məsələn, α-amin-asetat turşusu (qlikakol) NH2CH2COOH mislə qarşılıqlı təsirdə olduqda onun tərkibindəki karboksil qrupunun hidrogeni metal atomu ilə əvəz olunur, amin qrupu isə koordinasion rabitə vasitəsilə mərkəzi atomla birləşir. beləliklə, α-amin-asetat turşusu (qlikakol) NH2CH2COOH mislə daxili kompleks birləşmə əmələ gətirir. kompleks birləşmənin quruluşundan göründüyü kimi, mis ionu aminqrupu ilə azotun istifadə edilməmiş elektron cütləri vasitəsi ilə [Cu(NO3)4]2+ ionunda olduğu kimi koordinasion, karboksil qrupunun oksigeni ilə isə (CH3COO)2Cu-də olduğu kimi adi rabitə ilə birləşir.
Ümumiyyətlə, daxili kompleks birləşmələr metal ionunun üzvi reaktivlərlə həlqəvi kompleks birləşmələri olub, liqandın mərkəzi atomla ən az iki əsasi atomu heç olmasa bir hidrogeni əvəz olunmaqla birləşdikdə əmələ gəlir. Daxili kompleks birləşmələr neytral və ya müəyyən yükə malik ola bilər. Bu birləşmənin əsas xüsusiyyəti qapalı həlqənin əmələ gəlməsi və nəticədə mərkəzi atomun üzvi liqandın daxilinə çəkilməsidir.
Daxili kompleks duzlar bərk kristallik maddələr olmaqla ərimə temperaturları nisbətən yüksəkdir. Suda pis, lakin üzvi həlledicilərdə yaxşı həll olur. Onların özlərinə xas olan intensiv xarakterik rəngləri adətən kompleksəmələgətirici metal ionlarının rəngindən fərqlənir.
Kompleks birləşmələrin əmələgəlmə nəzəriyyələri
[redaktə | mənbəni redaktə et]İon rabitəsi nəzəriyyəsinə əsasən kompleks birləşmələrdə kimyəvi rabitənin mahiyyətini adi müvafiq molekullarda olduğu kimi müxtəlif yüklü ionların arasındakı cazibə qüvvəsi təşkil edir. Məsələn, xarici elektron təbəqəsində 5 elektronu olan azot atomu həmin təbəqəni 8 elektronlu davamlı təbəqəyə tamamlamaq üçün üç hidrogen atomunun elektronlarından istifadə edir. Beləliklə, azot və hidrogen atomlarında elektron sıxlığının dəyişməsi nəticəsində onlar bir-birini qarşılıqlı surətdə cəzb edir və amonyak molekulunu əmələ gətirir. Amonyak molekulunun ümumiyyətlə elektroneytral olmasına baxmayaraq, kossel azot ionunun elektrostatik sahəsinin başqa münasib ionun elektrostatik sahəsi ilə qarşılıqlı təsirinin mümkünlüyünü qəbul edir. Amonyak molekulunun hidrogen ionu ilə ammonium ionunu əmələ gətirməsi buna misal ola bilər. Kovalent rabitə nəzəriyyəsi kompleks birləşmələrin əmələ gəlməsini molekulda adi ortaq elektron cütlərinin donor-akseptor mənşəli elektron cütü ilə tamamlanması nöqteyi-nəzərdən izah edir. Məsələn, bu nəzəriyyəyə əsasən amonyak molekulu azot atomu ilə hidrogen atomları arasında üç ortaq elektron cütünün meydana çıxması nəticəsində əmələ gəlir. Amonyak molekulunun əmələ gəlməsi zamanı azotun bölünməmiş elektron cütü qalır. Kovalent rabitə nəzəriyyəsi müvafiq boş orbitala malik ion ilə qarşılıqlı təsir zamanı belə bölünməmiş elektron cütündən istifadəni mümkün hesab edir.
Kompleks birləşmələrin bioloji rolu
[redaktə | mənbəni redaktə et]Kompleks birləşmələr canlı orqanizmdə çox vacib rola və müxtəlif funksiyalara malikdir. Bunu izah etmək üçün xüsusilə hemoqlabin, xlorofil və s. üzərində dayanmaq kifayətdir. Hemoqlobin qlobin zülalından və qanın qırmızı piqmenti olan hemdən təşkil olunmuşdur. Hemoqlobinin qanda ən vacib funksiyası oksigeni ağ ciyərlərdən götürərək fasiləsiz surətdə toxumaların hüceyrələrinə daşımaqdan ibarətdir. Bu proses hemin tərkibində olan dəmirə oksigen molekulunun zəif şəkildə birləşməsi və hüceyrələrdə asan ayrılması ilə əlaqədardır. lakin, oksigenin hem ilə birləşməsi və ya ondan ayrılması proseslərinin mexanizmi indiyə kimi ətraflı öyrənilməmişdir. Hemoqlobinin tərkibində olan dəmir həmçinin CO molekulu və CN- ionu ilə birləşərək nisbətən davamlı birləşmə əmələ gətirir. Buna əsasən CO hemoqlobindən oksigeni asanlıqla sıxışdırıb çıxara bilir. CO-nun orqanizmə göstərdiyi kəskin toksik təsiri də bununla izah edilir. Müəyyən edilmişdir ki, orqanizmdə hemoqlobinin sintezində əsasən iki maddə iştirak edir.: siankobalamin və ya vitamin B12 və hemokuprein. Vitamin B12 üçvalentli kobaltın mürəkkəb üzvi liqandla əmələ gətirdiyi kompleks birləşmədir. Hemokupreinin tərkibində isə mis vardır. Onurğasız heyvanlarda oksigen daşıyıcısı hemosianın maddəsidir. Bu maddənin quruluşu tam şəkildə öyrənilməmişdir. lakin, aparılan ilk tədqiqatlar onun misin kompleks birləşməsi olduğunu göstərmişdir. Bitkilərin həyat fəaliyyətində son dərəcə mühüm əhəmiyyət kəsb edən xlorofil maqneziumun kompleks birləşməsidir. Xlorofil əslində bir-birinə çox oxşar olan iki birləşmənin qarşığından ibarətdir6 xlorofil A və xlorofil B.
Xlorofil planetimizdə həyatın varlığını təmin edən əsas kimyəvi proseslərdən biri olan fotosintez prosesinin gedişi üçün zəruri maddi amillərdən biridir.
Orqanizmin vacib kompleks birləşmələri qrupuna insulun də daxildir. Son illərdə aparılan tədqiqatlar nəticəsində insulinin sinkin kompleks birləşməsi olduğu müəyyən edilmişdir. İnsulin mədəaltı vəzidə hazırlanır və karbohidratların mübadiləsinə güclü təsir göstərərək qanda şəkərin miqdarını kəskin surətdə azaldır.
İstinadlar
[redaktə | mənbəni redaktə et]- Ахметов Н.С. Общая и неорганическая химия, 4 –е изд. –М. ; Высщаяшкола, 2002
- БеркусерИ.Б.Электронное строение и свойства координационных соединений. –Л. ; Химия, 1986
- Гликина Ф.Б., Ключников Н.Г. Химия комплексных соединений. М. Просвещение, 1967
- Костромина Н.А., Кумок В.Н., Скорик Н.А. химия координационных соединений. М.; Высщая школа, 1990
Mənbə
[redaktə | mənbəni redaktə et]- Z.Qarayev "Qeyri-üzvi kimya", Maarif - 1975.
![{\displaystyle {\ce {[Cu(NH3)4]2+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/67d46cc5268e02b803566b17cf811325d7246307)

![{\displaystyle {\ce {[Ni(CN)4]4-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/12b375ca09dbb6a61652a85a09d8b498ae6262c7)
![{\displaystyle {\ce {[Co(NH3)6]3+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9df1fb083aa583c6f916acfaf8046ce398c395c9)
![{\displaystyle {\ce {[BF4]-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a4e5854298a3330174a384f09a532a637f2f29c2)
![{\displaystyle {\ce {[CO3]2-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bd2037bdaedca2f541a5408ae84f743c22ba84e6)
![{\displaystyle {\ce {[Cr(H2O)6]Cl3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7e7c28743f3d1d178f1a1e5e87323a7a77fb3f3e)
![{\displaystyle {\ce {[Cu(H2O)4]SO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/07056cf29be5df8430ce2407a65c833a3f69c28d)
![{\displaystyle {\ce {[Fe(H2O)6]SO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/69bdcc67638484030d8085d11bd2ff5c3da6f774)

![{\displaystyle {\ce {[Zn(NH3)4]SO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f01da7f41765bf5902879dc2fe7109987f09479f)
![{\displaystyle {\ce {[Cu(NH3)4]Cl2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f953955684d84923505676880f5dba9c174af5f)
![{\displaystyle {\ce {[Ag(NH3)2]Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b26c2b20b3be8749036bf916646ad35c16baa178)
![{\displaystyle {\ce {K3[AlF6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/277a7b3fa07f05af6a11c5202948125a530773d3)
![{\displaystyle {\ce {K4[Fe(CN)6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/87705741ed45b8d1a642b7edfab78dcd3551ec0d)
![{\displaystyle {\ce {Na3[Al(OH)6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f3485a9d90ce8d9709280795c288312a8c9ae1e4)
![{\displaystyle {\ce {Na2[Zn(OH)4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/055ff6c53f637bf33efcfcb47eae53f86c5e73d0)
![{\displaystyle {\ce {K2[HgJ4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/de618913131ce8e4cf3e36460ac9c3c6ca73cac1)
![{\displaystyle {\ce {[PtCl4(NH3)2]0}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5586322dac5a6ad94e277a24838b7d0b8f58d3b1)
![{\displaystyle {\ce {[Co(NO2)3(NH3)3]0}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5f49606e334bbcde5cb421084ca93d786fa5ebe7)
![{\displaystyle {\ce {[Ni(CO)4]0}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f10862e35e17516b7125158f83d0497ae1a3ae76)
![{\displaystyle {\ce {[Ni(C6H6)2]0}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0241ae6e4a484905ef52bd19ed39f12558293b1d)
![{\displaystyle {\ce {[Fe(CO)5]0}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7d72c86fe92ffeddab119522f5ba5ccbf2b81913)
![sis-[CoCl2(NH3)4]+](https://upload.wikimedia.org/wikipedia/commons/thumb/b/be/Cis-dichlorotetraamminecobalt%28III%29.png/132px-Cis-dichlorotetraamminecobalt%28III%29.png)
![trans-[CoCl2(NH3)4]+](https://upload.wikimedia.org/wikipedia/commons/thumb/5/56/Trans-dichlorotetraamminecobalt%28III%29.png/150px-Trans-dichlorotetraamminecobalt%28III%29.png)
![-[CoCl3(NH3)3]](https://upload.wikimedia.org/wikipedia/commons/thumb/6/69/Fac-trichlorotriamminecobalt%28III%29.png/109px-Fac-trichlorotriamminecobalt%28III%29.png)
![-[CoCl3(NH3)3]](https://upload.wikimedia.org/wikipedia/commons/thumb/5/54/Mer-trichlorotriamminecobalt%28III%29.png/136px-Mer-trichlorotriamminecobalt%28III%29.png)
![Λ-[Fe(ox)3]3−](https://upload.wikimedia.org/wikipedia/commons/thumb/d/df/Delta-tris%28oxalato%29ferrate%28III%29-3D-balls.png/110px-Delta-tris%28oxalato%29ferrate%28III%29-3D-balls.png)
![Δ-[Fe(ox)3]3−](https://upload.wikimedia.org/wikipedia/commons/thumb/6/6e/Lambda-tris%28oxalato%29ferrate%28III%29-3D-balls.png/111px-Lambda-tris%28oxalato%29ferrate%28III%29-3D-balls.png)
![Λ-sis-[CoCl2(en)2]+](https://upload.wikimedia.org/wikipedia/commons/thumb/1/12/Delta-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png/78px-Delta-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png)
![Δ-sis-[CoCl2(en)2]+](https://upload.wikimedia.org/wikipedia/commons/thumb/8/81/Lambda-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png/78px-Lambda-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png)
![{\displaystyle {\ce {K[PtNH3Cl3]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c2a3c6923b23feaad51fc5d348ce7b405507fa0f)
![{\displaystyle {\ce {K[PtNH3Cl5]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2a891f8407f22f99c63b94650d6328607c0558d1)
![{\displaystyle {\ce {NH4[Cr(NH3)2(NCS)4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d6a13cdebf892acd6c280d2d920e22d10b76804e)
![{\displaystyle {\ce {K3[Co(NO2)6],}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ab7c6f177b444e853d780bf2773b845d343360c6)
![{\displaystyle {\ce {[Co(NH3)5Cl2]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dd9f031bdb80f871f258b77db45f4517bbfd3406)
![{\displaystyle {\ce {[Co(H2O)(NH3)5]Cl3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3fcbdc23b4aab42a43edcb8782111846cdb39c7e)







![{\displaystyle {\ce {[Co(NH3)5Cl]Cl2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ceff8acb281f9d0640692e09fddbfcfc00cde674)
![{\displaystyle {\ce {K2[Ni(CN)4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5c7f99c17efa1025a415ebff585fe6b7705b4167)
![{\displaystyle {\ce {NH4[Cr(NCS)4(NH3)2]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f641491184f7f12e97c60e7e81deab9dc3a3c095)
![{\displaystyle {\ce {[Hg(SCN)4]2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c35fb2e172d92fdc06841db73ed1a16a2f0735cd)


![{\displaystyle {\ce {K2[PtCl6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/67ce8048dfc8c0fc21783889b75144285940fb7e)
![{\displaystyle {\ce {[Cd(NH3)4]Cl2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/683888fb977406415739bd917bc993733a4522d1)
![{\displaystyle {\ce {[Cd(NH3)4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c3446dd45fcc0e13de00e9c7c3aa8b8c7c0ac5f9)