Kraun efirləri
Bu məqaləyə hansısa kateqoriya əlavə edilməmişdir. Məqaləyə kateqoriyalar əlavə edərək töhfə verə bilərsiz. |
Kraun efirlər (ingilis sözü crown – korona) – bir-birinin ardınca gələn etilen körpüləri -CH2-CH2- və oksigen atomlarından ibarət olan böyük tsiklik molekullardır (makrotsikllər). Bəzi hallarda O atomlarının bir hissəsi N və S atomları ilə əvəz edilib. Belə molekulların forması taca ("korona"ya) oxşayır ki, onların adı da buradan götürülüb (ingiliscə crown – korona). Kraun efirlərin makroheterotsiklində 11-dən çox atom olur ki, bunlardan ən azı 4-ü heteroatomdur. Kraun efirlərinin nomenklaturası:
- formula I — 12-kraun-4; (1,4,7,10-tetraoksatsiklododekan)
- formula II — 1,10-diaza-18-kraun-6; (4,7,13,16-tetraoksa-1,10-diazasikloоktadekan)
- formula III — 1,7-ditia-15-kraun-5
- formula IV — dibenzo-18-kraun-6
- formula V — tsikloheksano-15-kraun-5

Kraun efirlərin xassələri
[redaktə | mənbəni redaktə et]Formal olaraq bütün kraun efirləri heterotsiklik birləşmələr sinfinə aid etmək olar, lakin bu birləşmələrin qeyri-adi xassələri onların müstəqil sinfə ayrılmasına imkan verdi və bununla əlaqədar olaraq onların adılandırılması üçün xüsusi qaydalar təklif edildi. Addakı "kraun" sözün qarşısındakı rəqəm tsikldə olan atomların sayını, adın sonundakı rəqəm heteroatomların O, N və S sayını göstərir (şəkil 1). Adda tsikldə O atomlarının olması göstərilmir bu başa düşülür (nəzərdə tutulur), əgər tsikldə digər heteroatomlar (oksigendən başqa), məsələn azot yaxud kükürd varsa, onların sayı adın əvvəlinə di-, yaxud tri- söz önlüyü əlavə edilməklə, tsikldəki vəziyyəti rəqəm indeksləri ilə göstərilir, əvvəlcədən tsikldəki bütün atomlar nömrələnir. Kraun efirlərin tərkibində sadə efirlərə xas olan C-O-C fraqmenti olur, həmçinin onların tərkibində amin fraqmenti C-NH-C, yaxud tioefir frqmenti C-S-C ola bilir.
Kraun efirlərin qələvi metal kationları ilə kompleksləri
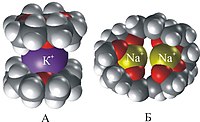
[redaktə | mənbəni redaktə et]Bu sinif maddələrin xarakterik xüsusiyyəti tərkibindəki oksigen, azot və kükürdün bölünməmiş elektron cütünün hesabına kompleks əmələ gətirmək qabiliyyətidir. Bu xüsusiyyət kraun efirlərində tsikldə çox sayda heteroatomların olması hesabına dəfələrlə güclüdür. Həm də ki, bölünməmiş elektron cütləri tsiklin içərisinə doğru yönəlib. Nəticədə qələvi və qələvi torpaq metalların ionları tsiklin içərisinə daxil olub, möhkəm komplekslər əmələ gətirir. Tsiklin böyüklüyünü və uyğun olaraq daxili boşluğun ölçüsünü dəyişərək, kraun efiri dəqiq olaraq müəyyən ölçülü kationun saxlanılmasına sazlamaq olar, məsələn, 12–kraun–4 (şəkil 1) litium kationunu daha möhkəm saxlayır, 15–kraun–5 ölçüsünə görə natrium kationuna uyğun gəlir, 18 — kraun-6 ölçüsünə görə kalium kationuna uyğun gəlir (şəkil 2).
Tsiklin daxili boşluğu ilə kationun ölçüsünün qarşılıqlı uyğunluğunu həcmi modellərin köməyi ilə daha bariz göstərmək olar (şəkil 2.).
Şəkil 2. 18 — kraun-6-nın K+ kationu ilə kompleksinin əmələ gəlməsi

Kraun efirlərin kationu "tutmaq" meyilliyi o qədər güclüdür ki, hətta əgər kation ölçüsünə görə tsiklik daxili boşluğuna uyğun gəlməsə belə, kationun saxlanma (tutulma) variantları mümkün olur. Məsələn, əgər kation ölçüsünə görə daxili boşluğun ölçüsündən xeyli böyükdürsə, onun ətrafı 2 kraun efiri ilə buterbrod şəkilli əhatələnə, yaxud kraun efir molekulunun daxilinə 2 kation yerləşdirə bilər.
Bu tip komplekslər kationun ölçüsünün molekuldaxili boşluğa dəqiq uyğun gəldiyi komplekslərə nisbətən daha az stabildir. Kraun efirlər sintetik üzvi kimyada yeni üfüqlər açıb, onların köməyi ilə qeyri-üzvi reagentləri həll edilmiş şəkildə (bir sözlə, homogen şəkildə) üzvi mühitə daxil etmək mümkün olub. Məsələn, geniş istifadə olunan oksidləşdirici kalium permanqanat KMnO4 üzvi həlledicilərdə praktiki olaraq həll olumur, lakin 18-kraun-6 iştirakında o, benzolda asan həll olur, həm də bu zaman daha yüksək oksidləşdirici qabiliyyətə malik olur. Bunun səbəbi oksidləşdirməni həyata keçirən MnO4- anionları su solvat qatı (buludu) ilə əhatə olunub, benzol məhlulunda isə onlar elə bil ki, çılpaqlaşıb və buna görə də yüksək fəaldır.
Kraun efirlərinin alınması
[redaktə | mənbəni redaktə et]Zəncirində C-O-C sadə efir qrupu saxlayan dixloralkanları polietilenqlikolla kondensləşdirdikdə tsiklləşmənin getməsi ilə kraun efir alınır. İlkin maddələrin zəncirinin uzunluğundan asılı olaraq müxtəlif ölçülü tsiklə malik kraun efirlər alınır. Azotsaxlayan kraun efirləri efir qrupu saxlayan diaminlərin dikarbon turşularının xloranhidridləri ilə kondensləşməsindən alırlar. Nəticədə tsiklik amidlər alınır ki, sonradan onlar reduksiya edilir və bu zaman C=O qrupları metilen qruplarına CH2 çevrilir. Kraun efirinin alınması:
Kraun efirlərinin tətbiqi
[redaktə | mənbəni redaktə et]Kraun efirlərinin tətbiqi, hər şeydən əvvəl onların seçiciliklə müəyyən ölçülü kationları tutma qabiliyyətinə əsaslanıb. Ən çox yayılan kraun efirləri yalnız O heteroatomu saxlayanlardır. Onlar qələvi və qələvi torpaq metal duzlarının ayrılması və təmizlənməsi ilə bağlı texnoloji proseslərdə, qeyri-üzvi birləşmələrin su fazasından üzvi mühitə keçirilməsi lazım olan sintezlərlə bağlı analitik tədqiqat və işlərdə tətbiq olunurlar. Kraun efirləri mikroblara və parazitlərə qarşı fəallıq göstərir, bundan başqa onların köməyi ilə toksiki ağır metal ionları, həmçinin radioaktiv litium və stronsium izotopları orqanizmdən çıxarılır. Kraun efirləri radiokimyada nüvə istehsalı tullantılarının emalı probleminin həllinə kömək edir. Birinci mərhələ emal edilmiş nüvə yanacığından kraun efirlərin köməyi ilə daha aktiv izotopların (stronsium-90, sezium 137, texnesium-99) ayrılmasıdır ki, bu mərhələdə yüksək radiasiya davamlılığına malik olan kükürdsaxlayan kraun efirlərindən istifadə daha məqsədəuyğundur. Çıxarılmış izotoplar sonradan rentgen cihazlarını əvəz edən radiodiaqnostika qurğularında, həmçinin meteostansiyalar, meteozondlar və kosmik aparatlar üçün üzunmüddətli cərəyan mənbələrinin yaradılmasında istifadə edilir. Reaktiv yanacağın emalının sonrakı mərhələsi kraun efirlərin (xüsusi seçilmiş tərkibi) köməyi ilə sərf edilməmiş uran və plutoniumun çıxarılmasıdır ki, bundan sonra ytilləşməyə uğradılacaq tullantıların həcmi nəzərəçarpacaq dərəcədə azalır və həmçinin artıq bu tullantılar az radioaktivliyə malik olur. Kraun efirləri əsasında yeni növ elektrik keçirici materiallar – elektridlər yaradılıb. Faktiki olaraq yeni sinif birləşmələr – kraun efirləri yaradan amerikalı kimyaçı Ç. Pederson makroheterotsiklik birləşmələr kimyasının inkişafındakı roluna görə 1987-ci ildə (D. Kram və J. Lenlə birlikdə) Nobel mükafatına layiq görülüb.

Mənbə
[redaktə | mənbəni redaktə et]- Ensiklopediya Kruqosvet
- https://www.krugosvet.ru/
- van der Ham, Alex; Hansen, Thomas; Lodder, Gerrit; Codée, Jeroen D. C.; Hamlin, Trevor A.; Filippov, Dmitri V. (2019). "Computational and NMR Studies on the Complexation of Lithium Ion to 8-Crown-4". ChemPhysChem. 20 (16): 2103–2109. doi:10.1002/cphc.201900496. ISSN 1439–7641. PMC 6772996. PMID 31282054.
- Yang, Zhao; Yu, Ga-Er; Cooke, Jennifer; Ali-Abid, Ziad; Viras, Kyriakos; Matsuura, Hiroatsu; Ryan, Anthony J; Booth, Colin (1996). "Preparation and crystallinity of a large unsubstituted crown ether, cyclic heptacosa(oxyethy1ene) (cyc2o=E2, 81-crown-27), studied by Raman spectroscopy, X-ray scattering and differential scanning calorimetry". J. Chem. Soc., Faraday Trans. 92 (17): 3173–3182. doi:10.1039/FT9969203173.
- Marczenko, K. M.; Mercier, H. P. A.; Schrobilgen, G. J. (2018). "A Stable Crown-Ether Complex with a Noble-gas Compound". Angew. Chem. Int. Ed. 57 (38): 12448–12452. doi:10.1002/anie.201806640. PMID 29953704. S2CID 49589053.
- Lipkowski, J.; Fonari, M. S.; Kravtsov, V. C.; Simonov, Y. A.; Ganin, E. V.; Gemboldt, V. O. (1996). "Antimony(III) fluoride: Inclusion complexes with crown ethers". J. Chem. Crystallogr. 26 (12): 823. doi:10.1007/BF01670315. S2CID 93153773.
- Pedersen, C. J. (1967). "Cyclic polyethers and their complexes with metal salts". Journal of the American Chemical Society. 89 (26): 7017–7036. doi:10.1021/ja01002a035.
- Pedersen, C. J. (1967). "Cyclic polyethers and their complexes with metal salts". Journal of the American Chemical Society. 89 (10): 2495–2496. doi:10.1021/ja00986a052.
- GB 785229, Stewart, D. G.; Waddan, D. Y. & Borrows, E. T., issued 1957-10-23
- Down, J. L.; Lewis, J.; Moore, B.; Wilkinson, G. (1959). "761. The solubility of alkali metals in ethers". Journal of the Chemical Society: 3767. doi:10.1039/jr9590003767.
- Pedersen, Charles J. (1988). "Macrocyclic Polyethers: Dibenzo-18-Crown-6 Polyether and Dicyclohexyl-18-Crown-6 Polyether". Organic Syntheses.; Collective Volume, vol. 6, p. 395
- Ashton, P. R.; Goodnow, T. T.; Kaifer, A. E.; Reddington, M. V.; Slawin, A. M. Z.; Spencer, N.; Stoddart, J. F.; Vicent, C.; Williams, D. J. (1989). "A [2] Catenane Made to Order". Angewandte Chemie International Edition in English. 28 (10): 1396–1399. doi:10.1002/anie.198913961.
- Liou, Chien-Chung; Brodbelt, Jennifer S. (July 1992). "Determination of orders of relative alkali metal ion affinities of crown ethers and acyclic analogs by the kinetic method". Journal of the American Society for Mass Spectrometry. 3 (5): 543–548. doi:10.1016/1044–0305(92)85031-e. ISSN 1044–0305. PMID 24234497.
- Christensen, J. J.; Izatt, R. M. (1978), "PREFACE", Synthetic Multidentate Macrocyclic Compounds, Elsevier, pp. ix–x, doi:10.1016/b978-0-12-377650-1.50005–8, ISBN 978-0-12-377650-1
- Frensdorff, Hans K. (February 1971). "Stability constants of cyclic polyether complexes with univalent cations". Journal of the American Chemical Society. 93 (3): 600–606. doi:10.1021/ja00732a007. ISSN 0002–7863.
- Shannon, R. D. (1976-09-01). "Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides". Acta Crystallographica Section A. 32 (5): 751–767. Bibcode:1976AcCrA..32..751S. doi:10.1107/s0567739476001551. ISSN 0567–7394.
- Fabbrizzi, L.; Francese, G.; Licchelli, M.; Pallavicini, P.; Perotti, A.; Poggi, A.; Sacchi, D.; Taglietti, A. (1997). Desvergne, J. P.; Czarnik, A. W. (eds.). Chemosensors of Ion and Molecule Recognition. NATO ASI Series C. Vol. 492. Dordrecht: Kluwer Academic Publishers. p. 75.
- Bouas-Laurent, H.; Desvergne, J. P.; Fages, F.; Marsau, P. (1993). A. W., Czarnik (ed.). Fluorescent Chemosensors for Ion and Molecule Recognition. ACS Symposium Series 538. Washington, DC: American Chemical Society. p. 59. ISBN 9780841227286.
- Sharghi, Hashem; Ebrahimpourmoghaddam, Sakineh (2008). "A Convenient and Efficient Method for the Preparation of Unique Fluorophores of Lariat Naphtho-Aza-Crown Ethers". Helvetica Chimica Acta. 91 (7): 1363–1373. doi:10.1002/hlca.200890148.
- Fuji, Kaoru; Tsubaki, Kazunori; Tanaka, Kiyoshi; Hayashi, Noriyuki; Otsubo, Tadamune; Kinoshita, Takayoshi (April 1999). "Visualization of Molecular Length of α,ω-Diamines and Temperature by a Receptor Based on Phenolphthalein and Crown Ether". Journal of the American Chemical Society. 121 (15): 3807–3808. doi:10.1021/ja9836444. ISSN 0002–7863.