Piktet-Spenqler reaksiyası
Piktet-Spengler reaksiyası — β-aril- etilaminin aldehid və ya keton ilə kondensasiyaya məruz qaldığı və sonra həlqənin bağlandığı kimyəvi reaksiyadır. Reaksiya ilk dəfə 1911-ci ildə Amé Piktet və Teodor Spenqler (22 fevral 1886 – 18 avqust 1965) tərəfindən kəşf edilmişdir.[1] Ənənəvi olaraq protik həlledicidə turşu katalizatoru qızdırma zamanı istifadə olunurdu[2], lakin sonradan reaksiyanın aprotik mühitdə daha yüksək məhsuldarlıqla getdiyi öyrənilmişdir.[3] Piktet-Spenqler reaksiyasını Mannix reaksiyasının xüsusi halı hesab etmək olar. Bu reaksiyanın hərəkətverici qüvvəsi turş mühitdə aldehid və aminin kondensasiyası nəticəsində yaranan iminium ionunun elektrofilliyidir. Bu, əksər hallarda turşu katalizatoruna ehtiyacla izah edilir, çünki imin həlqəsi bağlanmaq üçün kifayət qədər elektrofil deyil, lakin iminium ionu bu reaksiyaya daxil olur.
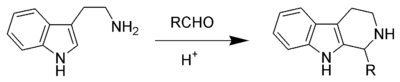
Piktet-Spenqler reaksiyası həm sənayedə, həm də biosintezdə geniş istifadə olunur. Aşkar olunduğu gündən bəri alkaloid və üzvi sintez sahələrində əhəmiyyətli bir reaksiya olaraq qalmışdır, burada bir çox β-karbolinlərin alınmasında istifadə edilmişdir. Təbii Piktet-Spenqler reaksiyası adətən striktosidin sintaza kimi bir fermentindən istifadə edir. Bioloji xammal kimi amin turşusu triptofan və müxtəlif aldozalar istifadə olunur. İndol və ya pirol kimi nukleofil aromatik həlqələr mülayim şəraitdə yüksək məhsul verir, fenil qrupu kimi daha az nukleofil aromatik həlqələr isə daha az məhsul verir və ya daha yüksək temperatur və qüvvətli turşu tələb edir. Piktet-Spenqler reaksiyası, tetrahidroizoxinolini meydana gətirən xlorid turşusunun katalizatorluğu ilə fenetilamin və dimetoksimetanın reaksiyasıdır. Piktet-Spenqler reaksiyası bərk fazaların birləşmələr kimyasına böyük müvəffəqiyyətlə tətbiq edilmişdir.[4][5] Aril-β-etanol ilə analoji reaksiya oksa-Piktet-Spenqler reaksiyası adlanır.[6] Mündəricat 1. Reaksiya mexanizmi 2. Çevrilmə 2.1. Piktet-Spenqler tetrahidroizoxinolin sintezi 2.2. N-asilinium ionu Piktet-Spenqler reaksiyası 2.3. Asimmetrik Piktet-Spenqler reaksiyası 3. İstinadlar
Reaksiya mexanizmi
[redaktə | mənbəni redaktə et]Reaksiya mexanizmi ilkin mərhələdə iminium ionunun (2) əmələ gəlməsi və ardınca 3-mövqeyində indolların gözlənilən nukleofilliyinə uyğun olaraq, spirotsiklin (3) alınması üçün elektrofil əlavə edilməsi ilə baş verir. Ən yaxşı miqrasiya qrupunun köçürülməsindən sonra deprotonasiya məhsulu (5) alınır.

Çevrilmə
[redaktə | mənbəni redaktə et]Piktet-Spengler tetrahidroizoxinolinin sintezi
[redaktə | mənbəni redaktə et]Bir indolun 3,4-dimetoksifenil qrupu ilə əvəz edilməsi nəticəsində Piktet-Spenqler tetrahidroizoxinolinin sintezi baş verir. Reaksiya şərtləri ümumiyyətlə indol variantında daha sərtdir və xlorid turşusu, triflüorasetal turşusu və ya qüvvətli turşuların püskürdülməsini tələb edir.[7][8]
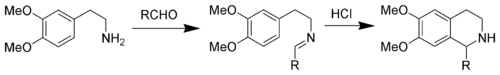
N-asiliminium ion Pictet–Spengler reaksiyası
[redaktə | mənbəni redaktə et]Piktet-Spenqler reaksiyası qüvvətli turşunun katalizatorluğu ilə, aralıq N-asilinium ionunu meydana gətirən iminium ionunun asilləşdirilməsi ilə gedir. N-asilinium ionu çox güclü elektrofildir və aromatik həlqə sistemlərinin çoxu yüksək məhsuldarlıqla mülayim şəraitdə tsiklləşəcək.[9]
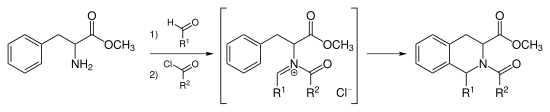
Tadalafil N-asilinium birləşməsi Piktet-Spenqler reaksiyası vasitəsilə sintez olunur.[10] Bu reaksiya AuCl3 və AgOTf katalizatorlarının iştirakı ilə də aparıla bilər.[11] Asimmetrik Piktet-Spenqler reaksiyası Piktet-Spenqler reaksiyası formaldehiddən başqa bir aldehidlə aparıldıqda yeni bir mərkəz yaranır. Bir neçə substrat və ya köməkçi diasteroselektiv Piktet-Spenqler reaksiyaları müəyyən edilmişdir.[12][13] Bundan əlavə, asimmetrik Piktet-Spenqler reaksiyalarında katalizator kimi tətbiq edilən xiral (optik aktiv birləşmələr) Bronsted turşusunu nəşr etdilər.[14] Triptofanlar: diastereo idarə olunan reaksiya Enantiopur triptofan və ya onun qısa zəncirli alkilefirlərinin reaksiyası 1,2,3,4-tetrahidro-β-karbolinin alınması ilə nəticələnir ki, burada C-1-də yeni xiral(optik aktiv) mərkəz C-3 karboksil qrupuna görə ya sis-, ya da trans- konfiqurasiyasını qəbul edir. Sis- vəziyyət kinetik olaraq idarə olunur, yəni daha aşağı temperaturda həyata keçirilir. Yüksək temperaturda reaksiya dönəndir. C1 və C3 üçün 13C NMR siqnalları trans məhsullara nisbətən sis məhsullarında aşağıya sürüşür.(bax: Sterik sıxılma effekti).[3][15]
İstinadlar
[redaktə | mənbəni redaktə et]- ^ Pictet, A.; Spengler, T. (1911). "Über die Bildung von Isochinolin-derivaten durch Einwirkung von Methylal auf Phenyl-äthylamin, Phenyl-alanin und Tyrosin". Berichte der Deutschen Chemischen Gesellschaft. 44 (3): 2030–2036. doi:10.1002/cber.19110440309.
- ^ Whaley, W. M.; Govindachari, T. R. (1951). "The Pictet-Spengler synthesis of tetrahydroisoquinolines and related compounds". Org. React. 6: 74.
- ^ Jump up to:a b Cox, E. D.; Cook, J. M. (1995). "The Pictet-Spengler condensation: a new direction for an old reaction". Chemical Reviews. 95 (6): 1797–1842. doi:10.1021/cr00038a004.
- ^ Nielsen, T. E.; Diness, F.; Meldal, M. (2003). "Solid-Phase Synthesis of Pyrroloisoquinolines via the Intramolecular N-Acyliminium Pictet-Spengler Reaction". Curr. Opin. Drug Discov. Dev. 6 (6): 801–814. PMID 14758752.
- ^ Nielsen, T. E.; Meldal, M. (2005). "Solid-Phase Synthesis of Pyrroloisoquinolines via the Intramolecular N-Acyliminium Pictet-Spengler Reaction". J. Comb. Chem. 7 (4): 599–610. doi:10.1021/cc050008a. PMID 16004504.
- ^ Larghi, E. L.; Kaufman, T. S. (2006). "The oxa-Pictet-Spengler Cyclization. Synthesis of Isochromanes and Related Pyran-Type Heterocycles". Synthesis (2): 187–210. doi:10.1055/s-2005–918502.
- ^ Yokoyama, Akihiro; Ohwada, Tomohiko; Shudo, Koichi (1999). "Prototype Pictet−Spengler Reactions Catalyzed by Superacids. Involvement of Dicationic Superelectrophiles". J. Org. Chem. 64 (2): 611–617. doi:10.1021/jo982019e.
- ^ Quevedo, R.; Baquero, E.; Rodriguez, M. (2010). "Regioselectivity in isoquinoline alkaloid Synthesis". Tetrahedron Letters. 51 (13): 1774–1778. doi:10.1016/j.tetlet.2010.01.115.
- ^ B. E. Maryanoff; H.-C. Zhang; J. H. Cohen; I. J. Turchi; C. A. Maryanoff (2004). "Cyclizations of N-acyliminium ions". Chem. Rev. 104 (3): 1431–1628. doi:10.1021/cr0306182. PMID 15008627.
- ^ Bonnet, D.; Ganesan, A. (2002). "Solid-Phase Synthesis of Tetrahydro-β-carbolinehydantoins via the N-Acyliminium Pictet-Spengler Reaction and Cyclative Cleavage". J. Comb. Chem. 4 (6): 546–548. doi:10.1021/cc020026h. PMID 12425597.
- ^ Youn, S. W. (2006). "Development of the Pictet-Spengler Reaction Catalyzed by AuCl3/AgOTf". J. Org. Chem. 71 (6): 2521–2523. doi:10.1021/jo0524775. PMID 16526809.
- ^ Gremmen, C.; Willemse, B.; Wanner, M. J.; Koomen, G.-J. (2000). "Enantiopure Tetrahydro-β-carbolines via Pictet-Spengler Reactions with N-Sulfinyl Tryptamines". Org. Lett. 2 (13): 1955–1958. doi:10.1021/ol006034t. PMID 10891200.
- ^ a) The intermolecular Pictet-Spengler condensation with chiral carbonyl derivatives in the stereoselective syntheses of optically-active isoquinoline and indole alkaloids Enrique L. Larghi, Marcela Amongero, Andrea B. J. Bracca, and Teodoro S. Kaufman Arkivoc (RL-1554K) pp 98–153 2005 (Online Review[permanent dead link]); b) Teodoro S. Kaufman "Synthesis of Optically-Active Isoquinoline and Indole Alkaloids Employing the Pictet-Spengler Condensation with Removable Chiral Auxiliaries Bound to Nitrogen". in "New Methods for the Asymmetric Synthesis of Nitrogen Heterocycles"; Ed.: J. L. Vicario. ISBN 81–7736-278-X. Research SignPost, Trivandrum, India. 2005. Chapter 4, pp. 99–147.
- ^ Seayad, J.; Seayad, A. M.; List, B. (2006). "Catalytic Asymmetric Pictet-Spengler Reaction". J. Am. Chem. Soc. 128 (4): 1086–1087. doi:10.1021/ja057444l. PMID 16433519.
- ^ Ungemach, F.; Soerens, D.; Weber, R.; Dipierro, M.; Campos, O.; Mokry, P.; Cook, J. M.; Silverton, J. V. (1980). "General method for the assignment of stereochemistry of 1,3-disubstituted 1,2,3,4-tetrahydro-β-carbolines by carbon-13 spectroscopy". J. Am. Chem. Soc. 102 (23): 6976–6984. doi:10.1021/ja00543a012.