
























несов. 1. гзаф ифирун, къизмишрун, яру авун (ракь). 2. чурун (цIал, цIук шабалтар, кIерецар)
Tam oxu »несов. 1. qızartmaq, közərtmək, qızdırmaq; калить железо dəmiri qızartmaq; 2. qovurmaq; калить орехи qozu (fındığı) qovurmaq; 3. xüs. su vermək (metal
Tam oxu »-лю, -лишь; калённый; -лён, -лена, -лено; нсв. см. тж. калиться, каление что 1) а) Сильно нагревать, доводить до раскалённого состояния. Калить камни
Tam oxu »сущ. кабина (небольшое помещение специального назначения). Təyyarəçi kabinəsi кабина летчика, kosmik gəmi kabinəsi кабина космического корабля, ekskav
Tam oxu »I сущ. тех. воен. калибр: 1. диаметр канала ствола огнестрельного оружия, орудия 2. диаметр снаряда или пули 3. точный, определенный размер каких-нибу
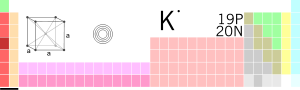
Tam oxu »I сущ. хим. калий (химический элемент из группы щелочных металлов серебристо-белого цвета) II прил. 1. калиевый (относящийся к калию, содержащий в себ
Tam oxu »сущ. геол. кальцит (минерал, природный углекислый кальций, составная часть мрамора, известняка и др.)
Tam oxu »I сущ. капитель: 1. архит. верхняя часть колонны или пилястра, служащая непосредственным переходом к покрытию 2. типогр. шрифт, буквы которого имеют н
Tam oxu »сущ. каратэ: 1. японская система защиты без оружия, основанная на ударах рукой или ногой по наиболее чувствительным местам тела противника 2. спорт. в
Tam oxu »1) qrun, dəstə (turistlərin, ziyarətçilərin və s.); 2) partiya; kitapların ilk kafilesi – kitabların ilk partiyası qafilə, qrun, partiya
Tam oxu »...комитет, rayon icraiyyə komitəsi районный исполнительный комитет, yerli komitə местный комитет; yoxsullar komitələri истор. комитеты бедноты (организ
Tam oxu »[fr.] 1. Budka şəklində kiçik otaq. Səsvermə kabinəsi. Pilot kabinəsi. Yük maşınının kabinəsi. Telefon kabinəsi
Tam oxu »[lat. əsli ər. əlkali] kim. Qələvi filizlər qrupundan gümüşü-ağ rəngli metal – kimyəvi element
Tam oxu »is. [ər.] Qadın (qız) katib. Qüdrətin qarabuğdayı katibəsi sürətlə şığıyıb içəri girdi. M.Hüseyn. Narınc çox kobud bir şəkildə katibəyə cavab verdi… S
Tam oxu »[fr. comite, əsli lat. committere – tapşırmaq] 1. Hər hansı bir işə rəhbərlik edən kollegial orqan. Partiya komitəsi
Tam oxu »[fr.] 1. xüs. Silah lüləsi diametrinin ölçüsü; çap. Kalibri böyük toplar. // Mərmi və ya güllənin diametri
Tam oxu »...гъалар. 2. пер. шудургъа, силиста; гьавайда вахт пучун; тянуть канитель буш кардал гьавайда вахт пучун.
Tam oxu »...arıqdır. Qantəmir. Şahnaz onun [Qurbanın] corablarını çıxarıb, qalife şalvarının balağını yuxarı çəkdi. İ.Şıxlı.
Tam oxu »сущ. галифе (брюки, облегающие колени, расширяющиеся кверху и заправляемые в сапоги). Qalife şalvar брюки галифе, qalife geyinmək носить галифе
Tam oxu »i. booth; (yük maşınında) cab; (liftdə) lift car; pilot ~si cockpit, cabin; seçki / səsvermə ~si polling booth
Tam oxu »1. KABİNƏ (minik maşınlarında kiçik otaq) Şofer kabinənin qapısını açıb onu [Firəngizi] maşına dəvət etdi (B.Bayramov); KABİNKA Maşın onlara çatanda d
Tam oxu »

























