DNT bağlayıcı protein



Bu məqaləni vikiləşdirmək lazımdır. |
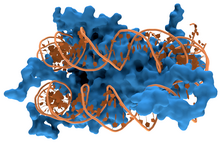
DNT ilə əlaqəli zülallar, DNT ilə əlaqəli domenlərə sahib olan və bu səbəbdən tək və ya cüt telli DNT üçün spesifik və ya ümumi yaxınlığa malik olan proteinlərdir. Seriyaya xas spesifik DNT ilə birləşdirən zülallar, baza cütlüyünü müəyyənləşdirən daha funksional qruplar açdıqları üçün, B-DNA əsas yiv ilə tipik olaraq qarşılıqlı əlaqə qururlar. Bununla birlikdə, netropsin, distamisin, Hoechst 33258, pentamidine, DAPI ve başqaları kimi kiçik yivlərin DNT-bağlayıcı bəzi bilinən bağları var[1][2].
Nümunələr
[redaktə | mənbəni redaktə et]DNT ilə əlaqəli zülallara transkripsiya prosesini modulyasiya edən transkripsiya faktorları, müxtəlif polimerazlar, DNT molekullarını parçalayan nükleazlar və hüceyrə nüvəsindəki xromosom qablaşdırmada və transkripsiyada iştirak edən histonlar daxildir. DNT-ni bağlayan zülallar, nükleik turşuya bağlanmağı asanlaşdıran sink barmaq, sarmal dönmə-sarmal və lösin fermuar (digərləri arasında) kimi sahələri əhatə edə bilər[3]. Transkripsiya aktivatoruna bənzər effektorlar kimi daha qeyri-adi nümunələr də var[4].
Spesifik olmayan DNT-protein qarşılıqlı təsirləri
[redaktə | mənbəni redaktə et]DNT-ni bağlayan struktur zülallar, spesifik olmayan DNA-protein qarşılıqlı təsirlərinin yaxşı başa düşülən nümunələridir. Xromosomlar daxilində DNT, struktur zülallarla komplekslərdə tutulur[5]. Bu zülallar DNT-ni kromatin adlanan kompakt bir quruluş halına gətirir. Eukariotlarda bu quruluş, histonlar adlanan kiçik bir əsas zülal kompleksinə DNT bağlanmasını ehtiva edir. Prokariotlarda bir çox növ zülal iştirak edir[6] . Histonlar, səthinə bükülmüş cüt telli DNT-nin iki tam növbəsini ehtiva edən nükleosom adlanan disk şəklində bir kompleks meydana gətirir. Bu spesifik olmayan qarşılıqlı təsirlər, DNT-nin asidik şəkər-fosfat onurğa sütunu ilə ion bağları meydana gətirən histonlardakı əsas qalıqlara görə meydana gəlir və bu səbəbdən də baza ardıcıllığından böyük dərəcədə müstəqildir[7]. Bu əsas amin turşusu qalıqlarına kimyəvi dəyişikliklər metilasyon, fosforilasiya və asetilasiyanı əhatə edir. Bu kimyəvi dəyişikliklər DNT ilə histonlar arasındakı qarşılıqlı təsir gücünü dəyişdirərək, DNT-ni transkripsiya faktorlarına az və ya çox dərəcədə əlçatan edir və transkripsiyanın dərəcəsini dəyişdirir. Kromatindəki digər spesifik olmayan DNT ilə əlaqəli zülallar, əyilmiş və ya təhrif olunmuş DNT ilə birləşən yüksək hərəkətlilik qrupu (HMG) zülallarını əhatə edir[8]. Biyofizik tədqiqatlar göstərir ki, bu memarlıq HMG zülalları bioloji funksiyalarını yerinə yetirmək üçün DNT-ni birləşdirir, bükür və ilmə edir. Bu zülallar nükleosom dizilərinin bükülməsi və xromosom əmələ gətirən daha böyük strukturlara düzülməsi üçün vacibdir[9].
Xüsusi olaraq tək telli DNT-ni bağlayan zülallar
[redaktə | mənbəni redaktə et]Əlavə məlumat: Tək zəncirli bağlayıcı protein Ayrı bir DNT bağlayan zülal qrupu, tək telli DNT-ni xüsusi olaraq bağlayan DNT bağlayan zülallardır. İnsanlarda replikasiya zülalı A bu ailənin ən çox araşdırılmış üzvüdür və DNT replikasiyası, rekombinasiyası və DNT təmiri də daxil olmaqla ikiqat sarmalın ayrıldığı proseslərdə istifadə olunur. Bu bağlayıcı zülalların tək telli DNT-ni sabitləşdirdiyi və nüvələr tərəfindən ilmə və ya parçalanmadan qoruduğu görünür[10].
Xüsusi DNT ardıcıllığına bağlanma
[redaktə | mənbəni redaktə et]Bunun əksinə olaraq, digər zülallar xüsusi DNT ardıcıllığına bağlanmaq üçün inkişaf etmişdir. Ən sıx araşdırılanlar, transkripsiyanı tənzimləyən zülallar olan müxtəlif transkripsiya faktorlarıdır. Hər bir transkripsiya faktoru müəyyən bir DNT ardıcıllığı qrupuna bağlanır və bu ardıcıllığa sahib olan genlərin təbliğçilərinin yanında transkripsiyasını aktivləşdirir və ya inhibə edir[11]. Transkripsiya faktorları bunu iki şəkildə edir. Birincisi, transkripsiyadan məsul olan RNT polimeraza birbaşa və ya digər vasitəçi zülallar vasitəsilə bağlana bilərlər; bu, promotorda polimerazın yerini tapır və transkripsiyaya başlamasına imkan verir. Alternativ olaraq, transkripsiya faktorları promotorda histonları dəyişdirən fermentləri birləşdirə bilər. Bu, polimeraz üçün DNT şablonunun mövcudluğunu dəyişdirir[12]. Bu DNT hədəfləri bir orqanizmin genomu boyunca tapıla bilər. Beləliklə, bir növ transkripsiya faktorunun fəaliyyətindəki dəyişiklik minlərlə geni təsir edə bilər[13]. Beləliklə, bu zülallar əksər hallarda ətraf mühit dəyişikliyinə və ya hüceyrələrin fərqlənməsinə və inkişafına cavabları idarə edən siqnal proseslərinin hədəfidir[14]. Bu transkripsiya amillərinin DNT ilə qarşılıqlı təsirinin xüsusiyyəti, DNT bazalarının kənarları ilə zülalların DNT ardıcıllığını oxumalarına imkan verən çoxsaylı təmaslarıdır. Baza ilə bu qarşılıqlı təsirlərin əksəriyyəti bazaların ən çox əldə edilə biləcəyi böyük yivdə baş verir. [21] Sütun spesifikliyini nəzərə alaraq zülal-DNT bağlanmasının riyazi təsvirləri, eyni zamanda müxtəlif növ zülalların rəqabətçi və kooperativ bağlanması adətən qəfəs modelləri istifadə olunur[15].
Zülal-DNT qarşılıqlı təsiri
[redaktə | mənbəni redaktə et]Protein-DNT qarşılıqlı təsirləri, bir zülalın bir DNT molekuluna bağlanması ilə baş verir, əksər hallarda DNT-nin bioloji funksiyasını, ümumiyyətlə gen ifadəsini tənzimləyir[16]. DNT-yə bağlanan zülallar arasında, DNT quruluşunun bir hissəsi olan və daha az spesifik olaraq ona bağlı olan DNT motivlərinə və histonlarına bağlanaraq gen ekspresyonunu aktivləşdirən və ya basdıran transkripsiya faktorları vardır. Urasil-DNA-glikosilaz kimi DNT-ni düzəldən zülallar da onunla sıx qarşılıqlı əlaqədə olur. Ümumiyyətlə, zülallar əsas yivdə DNT ilə birləşir; lakin istisnalar var. Zülal — DNT qarşılıqlı təsiri üçün xüsusi və ya spesifik olmayan qarşılıqlı olaraq iki növdür. Son tək molekullu təcrübələr göstərdi ki, DNT-yə bağlanan zülallar hədəf sahəni tanımaq üçün doğru şəkildə bağlanmaq üçün sürətli bir şəkildə geri qayıdır[17][18].
Dizayn
[redaktə | mənbəni redaktə et]Xüsusi bir DNT bağlanma yeri olan DNT ilə əlaqəli zülalların yaradılması biotexnologiyanın vacib bir hədəfi olmuşdur[19]. Sink barmaq zülalları, xüsusi DNT ardıcıllığına bağlanmaq üçün hazırlanmışdır və sink barmaq nükleazlarının onurğa sütunudur. Son zamanlarda, Xanthomonas bakteriyalarının müxtəlif bitki növlərinə sirayət etdikləri zaman III tip ifrazat sistemi vasitəsilə ifraz etdikləri təbii olaraq meydana çıxan zülallara əsaslanan transkripsiya aktivatoruna bənzər effektor nukleazlar (TALEN) inkişaf etdirilmişdir[20].
Tapılma metodları
[redaktə | mənbəni redaktə et]DNT-protein qarşılıqlı təsirlərini aşkar etmək üçün istifadə edilə bilən bir çox in vitro və in vivo üsul var. Hal hazırda istifadə olunan metodlardan bəziləri aşağıda verilmişdir: Elektroforetik Mobility Şift Assay (EMSA), bilinən DNT-ni bağlayan zülalların protein-DNT qarşılıqlı təsirlərini öyrənmək üçün geniş yayılmış keyfiyyət metodudur[21]. DNA-protein qarşılıqlı təsiri — fermentə bağlı immunosorbent analizi (DPI-ELISA) in vitro olaraq bilinən zülalların DNT ilə bağlanma seçimlərinin keyfiyyət və kəmiyyət analizini təmin edir. Bu metod DNT-yə bağlanan protein komplekslərinin analizinə imkan verir (DPI-İşə Alma-ELISA) və ya ELISA lövhəsindəki standart formatı sayəsində bir neçə nükleotid zondun avtomatik taranması üçün əlverişlidir[19] . DNT barmaq izi analizi baza cütlüyündə spesifik protein-DNT bağlanma sahələrini təyin etmək üçün istifadə edilə bilər. Xromatin immunoprecipitasiyası, bilinən transkripsiya faktorunun in vivo hədəf DNT bölgələrini təyin etmək üçün istifadə olunur[22]. Yüksək məhsuldarlıq sıralaması ilə birləşdirilən bu texnika, ChIP-Seq və mikro şüalarla birləşdirildikdə, ChIP-çip kimi tanınır. Maya bir hibrid sistemi, hansı zülalın müəyyən bir DNT parçasına bağlanacağını təyin etmək üçün istifadə olunur. Bakterial bir hibrid sistem, hansı zülalın müəyyən bir DNT parçasına bağlandığını təyin etmək üçün istifadə olunur[23]. X-şüa kristalloqrafiyasından istifadə edərək struktur təyini protein-DNT qarşılıqlı təsirləri barədə ətraflı bir atom anlayışı əldə etmək üçün istifadə edilmişdir[24][25].
Qarşılıqlı idarəetmə
[redaktə | mənbəni redaktə et]Protein-DNT qarşılıqlı təsirləri bufer ion gücü, makromolekulyar birləşmə, temperatur, pH və elektrik sahəsi kimi stimullarla tənzimlənə bilər[25]. Bu, protein-DNT kompleksinin geri çevrilə bilən ayrışmasına birləşməsinə səbəb ola bilər.
İstinadlar
[redaktə | mənbəni redaktə et]- ↑ Travers, A. A. DNA-protein interactions. London: Springer. 1993. ISBN 978-0-412-25990-6.
- ↑ Pabo CO, Sauer RT. "Protein-DNA recognition". Annu. Rev. Biochem. 53 (1). 1984: 293–321. doi:10.1146/annurev.bi.53.070184.001453. PMID 6236744.
- ↑ Sandman K, Pereira S, Reeve J. "Diversity of prokaryotic chromosomal proteins and the origin of the nucleosome". Cell Mol Life Sci. 54 (12). 1998: 1350–64. doi:10.1007/s000180050259. PMID 9893710.
- ↑ Luger K, Mäder A, Richmond R, Sargent D, Richmond T. "Crystal structure of the nucleosome core particle at 2.8 A resolution". Nature. 389 (6648). 1997: 251–60. Bibcode:1997Natur.389..251L. doi:10.1038/38444. PMID 9305837.
- ↑ Jenuwein T, Allis C. "Translating the histone code". Science. 293 (5532). 2001: 1074–80. CiteSeerX 10.1.1.453.900. doi:10.1126/science.1063127. PMID 11498575.
- ↑ Ito T. Nucleosome Assembly and Remodeling // Nucleosome assembly and remodelling. Curr Top Microbiol Immunol. Current Topics in Microbiology and Immunology. 274. 2003. 1–22. doi:10.1007/978-3-642-55747-7_1. ISBN 978-3-642-62909-9. PMID 12596902.
- ↑ Thomas J. "HMG1 and 2: architectural DNA-binding proteins". Biochem Soc Trans. 29 (Pt 4). 2001: 395–401. doi:10.1042/BST0290395. PMID 11497996.
- ↑ Murugesapillai, Divakaran; McCauley, Micah J.; Huo, Ran; Nelson Holte, Molly H.; Stepanyants, Armen; Maher, L. James; Israeloff, Nathan E.; Williams, Mark C. "DNA bridging and looping by HMO1 provides a mechanism for stabilizing nucleosome-free chromatin". Nucleic Acids Research. 42 (14). 2014: 8996–9004. doi:10.1093/nar/gku635. PMC 4132745. PMID 25063301.
- ↑ Murugesapillai, Divakaran; McCauley, Micah J.; Maher, L. James; Williams, Mark C. "Single-molecule studies of high-mobility group B architectural DNA bending proteins". Biophysical Reviews. 9 (1). 2017: 17–40. doi:10.1007/s12551-016-0236-4. PMC 5331113. PMID 28303166.
- ↑ Iftode C, Daniely Y, Borowiec J. "Replication protein A (RPA): the eukaryotic SSB". Crit Rev Biochem Mol Biol. 34 (3). 1999: 141–80. doi:10.1080/10409239991209255. PMID 10473346.
- ↑ Myers L, Kornberg R. "Mediator of transcriptional regulation". Annu Rev Biochem. 69 (1). 2000: 729–49. doi:10.1146/annurev.biochem.69.1.729. PMID 10966474.
- ↑ Li Z, Van Calcar S, Qu C, Cavenee W, Zhang M, Ren B. "A global transcriptional regulatory role for c-Myc in Burkitt's lymphoma cells". Proc Natl Acad Sci USA. 100 (14). 2003: 8164–9. Bibcode:2003PNAS..100.8164L. doi:10.1073/pnas.1332764100. PMC 166200. PMID 12808131.
- ↑ Teif V.B.; Rippe K. "Statistical-mechanical lattice models for protein-DNA binding in chromatin". Journal of Physics: Condensed Matter. 22 (41). 2010: 414105. arXiv:1004.5514. Bibcode:2010JPCM...22O4105T. doi:10.1088/0953-8984/22/41/414105. PMID 21386588.
- ↑ Pabo C, Sauer R. "Protein-DNA recognition". Annu Rev Biochem. 53 (1). 1984: 293–321. doi:10.1146/annurev.bi.53.070184.001453. PMID 6236744.
- ↑ Bewley CA, Gronenborn AM, Clore GM. "Minor groove-binding architectural proteins: structure, function, and DNA recognition". Annu Rev Biophys Biomol Struct. 27. 1998: 105–31. doi:10.1146/annurev.biophys.27.1.105. PMC 4781445. PMID 9646864.
- ↑ Ganji, Mahipal; Docter, Margreet; Le Grice, Stuart F. J.; Abbondanzieri, Elio A. "DNA binding proteins explore multiple local configurations during docking via rapid rebinding". Nucleic Acids Research. 44 (17). 2016-09-30: 8376–8384. doi:10.1093/nar/gkw666. ISSN 0305-1048. PMC 5041478. PMID 27471033.
- ↑ Clark KJ, Voytas DF, Ekker SC. "A TALE of two nucleases: gene targeting for the masses?". Zebrafish. 8 (3). September 2011: 147–9. doi:10.1089/zeb.2011.9993. PMC 3174730. PMID 21929364.
- ↑ Hianik T, Wang J. "Electrochemical Aptasensors – Recent Achievements and Perspectives". Electroanalysis. 21 (11). 2009: 1223–1235. doi:10.1002/elan.200904566.
- ↑ 1 2 Galas DJ, Schmitz A. "DNAse footprinting: a simple method for the detection of protein-DNA binding specificity". Nucleic Acids Res. 5 (9). 1978: 3157–3170. doi:10.1093/nar/5.9.3157. PMC 342238. PMID 212715.
- ↑ Cai YH, Huang H. "Advances in the study of protein–DNA interaction". Amino Acids. 43 (3). July 2012: 1141–6. doi:10.1007/s00726-012-1377-9. PMID 22842750.
- ↑ Fried M, Crothers DM. "Equilibria and kinetics of lac repressor-operator interactions by polyacrylamide gel electrophoresis". Nucleic Acids Res. 9 (23). 1981. doi:10.1093/nar/9.23.6505. PMC 327619. PMID 6275366.
- ↑ Garner MM, Revzin A. "A gel electrophoresis method for quantifying the binding of proteins to specific DNA regions: application to components of the Escherichia coli lactose operon regulatory system". Nucleic Acids Res. 9 (13). 1981. doi:10.1093/nar/9.13.3047. PMC 327330. PMID 6269071.
- ↑ Brand LH, Henneges C, Schüssler A, Kolukisaoglu HÜ, Koch G, Wallmeroth N, Hecker A, Thurow K, Zell A, Harter K, Wanke D. "Screening for protein-DNA interactions by automatable DNA-protein interaction ELISA". PLoS One. 8 (10). 2013. doi:10.1371/journal.pone.0075177. PMID 24146751.
- ↑ Brand LH, Kirchler T, Hummel S, Chaban C, Wanke D. "DPI-ELISA: a fast and versatile method to specify the binding of plant transcription factors to DNA in vitro". Plant Methods. 25 (6). 2010. doi:10.1186/1746-4811-6-25. PMID 21108821.
- ↑ 1 2 Fischer SM, Böser A, Hirsch JP, Wanke D. "Quantitative Analysis of Protein-DNA Interaction by qDPI-ELISA". Methods Mol. Biol. (1482). 2016: 49–66. doi:10.1007/978-1-4939-6396-6_4. PMID 27557760.