Hidrazin
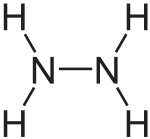
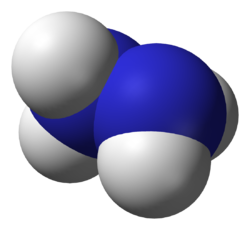
Hidrazin (diamin) H2N—NH2 —rəngsiz, xoşagəlməz iyə malik olan hiqroskopik mayedir.
| Hidrazin | |
|---|---|
 | |
 | |
| Ümumi | |
| Kimyəvi formulu | N₂H₄[1] |
| Molyar kütlə | 0 kq |
| Fiziki xassələri | |
| Sıxlıq | 1,01 q/sm³[2] |
| Termik xüsusiyyətlər | |
| Ərimə nöqtəsi | 2,2 °C[2] |
| Qaynama nöqtəsi | 113,3 °C[2] |
| Buxarın təzyiqi | 1.333,2 Pa[2] |
| Kimyəvi xassələri | |
| Turşunun dissosasiya sabiti | 8,1 ± 0,01[3] |
| Təsnifatı | |
| CAS-da qeyd. nöm. | 302-01-2 |
| PubChem | 9321 |
| RTECS | MU7175000 |
| ChEBI | 15571 |
| BMT nömrəsi | 2029, 2030, 3293 |
| ChemSpider | 8960 |
Qrupu
[redaktə | mənbəni redaktə et][4]N2H4 molekulu bir-birinə əks istiqamətdə yerləşlmiş 2 dənə NH2 qrupundan ibarətdir , μ = 0,62•10−29 Кл • м. Müxtəlif nisbətlərdə su ilə,amonyakla, etanolla qarışır. Qeyri polyar həlledicilərdə pis həll olur. Arilhidrazin və alkilhidrazin üzvi birləşmələrini əmələ gətirir.
Tarixi
[redaktə | mənbəni redaktə et]1887-ci ildə Teodor Kurtsiy tərəfindən kəşf edilib. Hidrazinin ilk törəməsi, yəni hidrazobenzol 1845-ci ildə Nikolay Zinin tərəfindən əldə edilmişdir. O, azobenzolu natrium sulfidlə reduksiya etmişdir. Yaranan maddənin tərkibində -NH-NH- fraqmenti var idi. 30 il sonra alman kimyaçıları Emil və Otto Fişer fenilhidrazin C6H5NHNH2-ni təcrid etdilər, lakin onun tərkibindəki fenil qrupunu hidrogenlə əvəz edə bilmədilər.
Alınması
[redaktə | mənbəni redaktə et]Hidrazin ammonyakın və ya sidik cövhərinin natrium hipoxloritlə oksidləşməsindən alınır (Raşiq metodu)
- NH3+NaOCl →NH2Cl+NaOH
- NH2Cl+NH3→ N2H4 HCl
Reaksiya 160oC-də, 2,5-3,0 MПа təzyiqdə aparılır. Sidik cövhərinin hipoxloritlə oksidləşməsi ilə hidrazinin alınması üsulu, Hofman metoduna görə amidlərdən aminlərin alınması üsulu mexanizminin analoqudur.
- (NH2)2CO+NaOCl+2NaOH→N2H4+H2O+NaCl+Na2CO3
Reaksiya 100oC-də və atmosfer təzyiqində aparılır. Bayer üsulu da istifadə edilir:
- 2NH3+H2O2→N2H4+2H2O
Xassələri
[redaktə | mənbəni redaktə et]Termodinamiki olaraq hidrazin ammonyaka nisbətən davamsızdır, belə ki, N—N rabitəsi möhkəm deyil. Hidrazinin parçalanma reaksiyası ekzotermik prosesdir. Bu reaksiya 200—300 °С-də keçid elementləri olan (Co, Ni, Cu, Ag) iştirakı ilə gedir:
- 3N2H4→4NH3+N2
- N2H4→N2+2H2
Hidrazinin müxtəlif duzları məlumdur: hidrazin xlorid N2H5Cl, hidrazin sulfat N2H6SO4 və s. Bəzən formulları belə yazılır
- N2H4 • HCl; N2H4 • H2SO4
hidrazin hidroxlorid,hidrazin sulfat kimi adlandırılır. Əksər belə duzlar rəngsiz olub, suda yaxşı həll olurlar.
- N2H4+HCl→[N2H5]Cl
Hidrazin quvvətli reduksiyaedicidir.Məhlullarda sərbəst azota qədər oksidləşir:
- 4KMnO4+5N2H4+6H2SO4→5N2+4MnSO4+2K2SO4+16H2O
Hidrazini reduksiya etmək üçün daha qüvvətli reduksiyaedicilərdən istifadə edilir: məs. Sn2+, Ti3+,eləcə də (Zn + HCl)reaksiyası zamanı yaranan hidrogenlə:
- N2H4+Zn+4HCl→2NH4Cl+ZnCl2
Hava oksigeni ilə azot, ammonyak və suya qədər oksidləşir. Hidrazin-hidrat, hidrazin-sulfat, hidrazin-xlorid qızılın, gümüşün və platin metalların duz məhlullarından reduksiya edilməsində istifadə edilir.
Bəzi aldehidlərlə( əsasən p-dimetilaminobenzaldehidlə) rəngli hidrazonların əmələ gəlməsi onları təyin etməyə imkan verir. Tədqiqatlar göstərmişdir ki, arilsulfoxloridlərlə hidrazin arasındakı reaksiyada hidrazinin miqdarı 1,5-2,0 molyar artıq olduqda belə mono və disulfamid alınır və bu şəraitdə monosulfamidin çıxımı 31% olur. Natrium-sulfatın katalitik təsiri ilə monosulfamidin çıxımını 43,5%-ə qədər qaldırmaq mümkün olmuşdur. Sulfoxloridlərlə hidrazin törəmələri arasındakı reaksiya nəticəsində 4-benzilsulfonilpiridin-2-karboksihidrazidlər alınmışdır . Molyar nisbət 2:1 olduqda disulfamid alınır.
Tətbiqi
[redaktə | mənbəni redaktə et]Hidrazin üzvi sintezdə, plastmas, rezin, raket yanacağınin tərkibindəki partlayıcı maddələrin istehsalında istifadə edilir. Hidrazin sulfat ağ ciyər, süd vəzləri, mədə, mədəaltı vəz xərçəngində, bəd xassəli şişlərin metastaz formasında və digər xəstəliklərdə istifadə olunur. Hidrazin həmçinin, aşağı temperaturlu hidrazin-hava yanacaqlarında yanacaq kimi tətbiq edilir. Kimya sənayesində reduksiyaedici kimi(oksigeni) geniş istifadə olunur.
- N2H4+O2=N2+2H2O
Toksiklik
[redaktə | mənbəni redaktə et]Hidrazin və onun törəmələrinin əksəriyyəti məməlilər üçün çox zəhərlidir. Hidrazin canlı orqanizmlərə ümumi zəhərli təsir göstərir. Kiçik qatılıqlarda hidrazin gözlərin və tənəffüs yollarının qıcıqlanmasına səbəb olur. Konsentrasiyanın artması ilə başgicəllənmə, baş ağrısı və ürəkbulanma başlayır. Bunun ardınca zəhərli pulmoner ödem və onlardan sonra - sonrakı ölümlə -koma ilə nəticələnə bilər. İş sahəsinin havasında tövsiyə olunan miqdar MPC = 0,1 mq/m3.
Mənbə
[redaktə | mənbəni redaktə et]- Ахметов Н. С. Общая и неорганическая химия. — 4-е изд., испр. — М.: Высшая школа, 2003. — 743 с. — ISBN 5-06-003363-5.
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. Учебное пособие для вузов. — 4-е изд., стер. — М.: Химия, 2000. — 592 с., ил. — ISBN 5-7245-1130-4; ББК 540 К 21; УДК 546(075.8).
- Третьяков Ю. Д. и др. 15.3.3.1. Водородные соединения азота и их производные. Гидразин. Гидроксиламин. // Неорганическая химия. Химия элементов: Учебник для вузов. В 2 книгах. Кн. II / Ю. Д. Третьяков, Л. И. Мартыненко, А. Н. Григорьев, А. Ю. Цивадзе. — М.: Химия, 2001. — С. 869-872. — 583 с., ил. — ISBN 5-7245-1214-9; ББК 24.1 (я 7); УДК 546 Т 66.
- Одрит Л., Огг Б. Химия гидразина = The Chemistry of Hydrazine. — М.: ИИЛ, 1954. — 238 с., ил.
İstinadlar
[redaktə | mənbəni redaktə et]- ↑ HYDRAZINE (ing.).
- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0329.html.
- ↑ Hall H. K. Correlation of the Base Strengths of Amines 1 (ing.). // J. Am. Chem. Soc. / P. J. Stang ACS, 1957. Vol. 79, Iss. 20. P. 5441–5444. ISSN 0002-7863; 1520-5126; 1943-2984 doi:10.1021/JA01577A030
- ↑ Ахметов Н. С. Общая и неорганическая химия. — 4-е изд., испр. — М.: Высшая школа, 2003. — 743 с. — ISBN 5-06-003363-5.
