Pirrol
Pirrol (C4H5N) – beşüzvlü bir azot atomundan ibarət heterotsiklik aromatik birləşmədir.
| Pirrol | |
|---|---|
 | |
 | |
| Ümumi | |
| Sistematik adı | Pirrol |
| Kimyəvi formulu | C4H5N |
| Molyar kütlə | 67,09 q/mol |
| Fiziki xassələri | |
| Sıxlıq | 0,967 q/sm³ |
| Termik xüsusiyyətlər | |
| Ərimə nöqtəsi | -238 °S |
| Qaynama nöqtəsi | 130 °S |
| Buxarın təzyiqi | 1,1 kPa[1][2] |
| Kimyəvi xassələri | |
| Turşunun dissosasiya sabiti | −3,8[3] |
| Optik xüsusiyyətlər | |
| Sındırma əmsalı | 1,5085[4] |
| Təsnifatı | |
| CAS-da qeyd. nöm. | 109-97-7 |
| PubChem | 8027 |
| RTECS | UX9275000 |
| ChEBI | 19203 |
| ChemSpider | 7736 |
Ümumi məlumat
[redaktə | mənbəni redaktə et]Zəif turşu xassəsinə malikdir.Sümük yağında (heyvan mənşəli sürtkü yağı), eləcə də daşkömür qatranında olur . Pirrol həlqələri hemoqlabin tərkibində də vardır.
Alınması
[redaktə | mənbəni redaktə et]Qarışıq pirrollar Paal-Knorr reaksiyasına əsasən alınır. Yəni 1,4 diketonların amonyakla və ya aminlərlə reaksiyası nəticəsində alınır.Laboratoriyada ammonium duzlarının turş (qalaktozanın oksidləşməsindən asanlıqla alınır) mühitdə pirolizindən alınır:


Xassələri
[redaktə | mənbəni redaktə et]Rəngsiz, xloform iyli, havada tündləşən , yüngül hidroskopik , suda qismən, lakin üzvi həlledicilərdə yaxşı həll olan maddədir. Qələvi metallar və onların amid duzları ilə maye ammonim mühitində reaksiyaya daxil olur. Qrinyar reaktivləri ilə analoji reaksiyalar baş verir. Nəticədə N-maqnezium duzları əmələ gəlir.
- RX+Mg → RMgX
Pirrol zəif turş –NH- (pKa17,5 suda) xassəyə malikdir. Hidratlaşma nəticəsində pirolidin əmələ gəlir. Pirrolun sulfamid birləşmələri alınmışdır. 1,3-diketonla (asetilaseton) reaksiyaya girərək pirrolsulfamidlər əmələ gətirir.
Kimyəvi xassələri
[redaktə | mənbəni redaktə et]Kimyəvi xassələri.
Pirrol azotunun tək elektron cütü əsasən tsiklik π-konfiqurasiyada iştirak edir, aktiv deyil və buna görə də pirrol çox aşağı əsaslıq xassəsi nümayiş etdirir (sıxılmış turşunun pH= -3,8). Hesablamalar göstərir ki, mümkün pirrol kationları arasında α-mövqelərində karbon atomunun protonlaşmasının nəticəsi olan I kation termodinamik cəhətdən ən əlverişlidir. N-kation III ən az stabildir, çünki yük bir atomda cəmlənir və aromatik birləşmə sistemi pozulur: bu əslində bir diendir. II kation aralıq mövqe tutur.
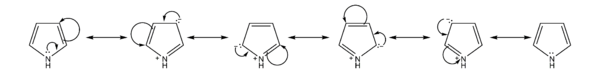 I tip kationlara uyğun olan kristallik duzlar inert həlledicilərdə polialkilpirrolların məhlullarından quru HCl keçirərək ayırmaq olar. Qeyd etmək lazımdır ki, III kationun az enerjisinə baxmayaraq, daha sürətli əmələ gəlir. Turş mühitdə karbonla müqayisədə pirrolun azot atomunda protonun daha asan deuterium mübadiləsi buna sübutdur. Bu hadisəyə kinetik əsaslıq deyilir. Azotun kinetik əsaslığı həmişə karbondan yüksəkdir.
C-kation II olması, "pirrol-qırmızı" dəyişkən quruluşlu bir polimer meydana gəldikdə, turş mühitdə pirrolun polimerləşməsinə səbəb olur. Bu reaksiyanın ilk mərhələlərinin mexanizmi təcrid olunmuş trimerin quruluşu ilə təsdiq edilmişdir.
I tip kationlara uyğun olan kristallik duzlar inert həlledicilərdə polialkilpirrolların məhlullarından quru HCl keçirərək ayırmaq olar. Qeyd etmək lazımdır ki, III kationun az enerjisinə baxmayaraq, daha sürətli əmələ gəlir. Turş mühitdə karbonla müqayisədə pirrolun azot atomunda protonun daha asan deuterium mübadiləsi buna sübutdur. Bu hadisəyə kinetik əsaslıq deyilir. Azotun kinetik əsaslığı həmişə karbondan yüksəkdir.
C-kation II olması, "pirrol-qırmızı" dəyişkən quruluşlu bir polimer meydana gəldikdə, turş mühitdə pirrolun polimerləşməsinə səbəb olur. Bu reaksiyanın ilk mərhələlərinin mexanizmi təcrid olunmuş trimerin quruluşu ilə təsdiq edilmişdir.
Pirrol turşularının təsiri altında polimerləşməsi pirrolların elektrofillərlə reaksiyalarda iştirakına ciddi məhdudiyyətlər qoyur, çünki bu növün bir çox çevrilməsi turş mühitin olmasını tələb edir.
Azot atomunda reaksiyalar
[redaktə | mənbəni redaktə et]Pirrolun turşuluğu (pH =17.0) etanola (pH= 15.9) yaxındır və güclü əsaslar onu tsiklopentadienilin yüksək π-artıq heteroanaloqu olan pirril anionuna çevirə bilir. Metal və ya qələvi metal amidlərinin təsiri ilə əldə edilən pirrolun natrium və kalium duzları asanlıqla elektrofillərlə qarşılıqlı əlaqəyə girir - onlar azot atomunda alkilləşir və asetilləşir, qarışıq N-pirrilmaqnezium halogenidləri (N-Mg rabitəsi N- Na dən daha az ion təbiətlidir.) əsasən nüvənin α-mövqeyində reaksiya verir.
Asetilləşmənin kinetik məhsulu, N-asetilpirrol qızdırilma şəraitində katalizator olmadıqda, termodinamik cəhətdən daha sabit bir məhsula, 2-asetilpirrola çevrilir.
Karbon atomlarında reaksiyalar
[redaktə | mənbəni redaktə et]Neytral və turş mühitdə pirrollar azot atomunda elektrofillərlə demək olar ki, heç vaxt reaksiyaya girmirlər. Elektrofil hücum əsasən nüvənin α-mövqelərinə yönəldilir. Bu onunla izah olunur ki, bu halda əmələ gələn I tipli σ-komplekslər, protonlaşma halında olduğu kimi, bütün mümkün olanlar arasında daha sabitdir.
Nitratlaşdırıcı qarışıq pirrolun sürətli parçalanmasına səbəb olur, buna görə də nitritləşmə üçün xüsusi reaktivlər - əvvəlcədən 70% HNO3 və sirkə anhidridindən hazırlanmış asetil nitrat və ya sulu olmayan həlledicilərdə kristal nitrit tetraflorboratdan istifadə olunur. İkinci halda (daha yüngül reaktiv) məhsuldarlıq daha yüksəkdir. α- və β-izomerlərin nisbəti təxminən 4:1-dir.

Sulfatlaşma
[redaktə | mənbəni redaktə et]Pirrolun asidofob təbiətinə görə oleum ilə sulfonlaşdırılması mümkün deyil; lakin piridin sulfontrioksid adlanan piridinlə SO3 kompleksindən istifadə etməklə yaxşı məhsuldarlıqda pirrol-2-sulfat turşusu əmələ gəlir.
Halogenləşmə
[redaktə | mənbəni redaktə et]Pirrolların molekulyar halogenlərlə qarşılıqlı təsiri, bir qayda olaraq, bütün sərbəst hidrogen atomlarının dəyişməsinə gətirib çıxarır; eyni zamanda, kükürd xlorid, soyuduqda, α-mövqeyində pirrolu monoxlorlaşdırır.
Tətbiqi
[redaktə | mənbəni redaktə et]Pirrol polimerləşmə reaksiyalarında, metal üzvi birləşmələrin alınmasında, dezinfeksiyaedici maddələrin istehsalında, tibbdə antibiotik maddələrin istehsalında istifadə edilir.
Mənbə
[redaktə | mənbəni redaktə et]- Tularik J., Medina T. Бензолсульфонамиды и бензамиды в качестве лекарственных средств. Пат. США 6583161. Заявл. 12.12.2000, Опубл. 24.06.2003; РЖХим -04.03-19О.60П
- Matsuniotosi H.J., Hanma T., Koizumi T., Akohine S.H.// Совместимые лекарства. Заявка 1679067 ЕПВ. Заявл. 16.09.2004. Опубл. 12.07.2006; РЖХим-07.23-19О.89П
- Lin X., Dorr H., Nuss J.M. Использование сульфамидной защитной группы Фукуямы для синтеза N- замещенных α-аминокислот и производных// Tetrahedron Lett. 2000, V. 41, № 18, p. 3309-3313. РЖХим-01.07-19Е.130
- Don Aproscienas U.C., Gonzales M.A., Otterkecher E.W. Pracess For The preparation of 2-alkoxy -6-trifluoromethyl-N- [1,2,4] triazolo-[1,5-C]pirimidin-2-yl) benzolsulfonamides. Pat. USA 6433169. Заявл. 24.09.2001. Опубл. 13.08.2002, РЖХим-03.05-19О.343П
- Эльдерфилд Р. (ред.) Гетероциклические соединения // М. — ГИзИЛ 1953 том 1 сс. 219—269
- CRC Handbook of Chemistry and Physics / W. M. Haynes — 97 — Boca Raton: 2016. — P. 9–65. — ISBN 9781498754286
- Paal—Knorr Pyrrole Synthesis (недоступная ссылка — история). Архивировано 7 февраля 2008 года.
- McElvain S. M., Bolliger K. M. Pyrrole // Organic Syntheses. — 1929. — Vol. 9. — P. 78. — DOI:10.15227/orgsyn.009.0078.
- ↑ CRC Handbook of Chemistry and Physics (ing.). / W. M. Haynes 97 Boca Raton: 2016. P. 15–19. ISBN 978-1-4987-5428-6
- ↑ CRC Handbook of Chemistry and Physics (ing.). / W. M. Haynes 97 Boca Raton: 2016. P. 16–29. ISBN 978-1-4987-5428-6
- ↑ CRC Handbook of Chemistry and Physics (ing.). / W. M. Haynes 97 Boca Raton: 2016. P. 5–96. ISBN 978-1-4987-5428-6
- ↑ CRC Handbook of Chemistry and Physics (ing.). / W. M. Haynes 97 Boca Raton: 2016. P. 3–478. ISBN 978-1-4987-5428-6
