Rutenium (VIII)oksid
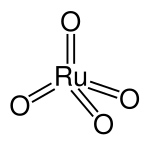
Rutenium (VIII) oksid – formulu RuO4 olan qeyri-üzvi birləşmədir.
| Rutenium (VIII)oksid | |
|---|---|
 | |
 | |
| Ümumi | |
| Sistematik adı | Rutenium (VIII) oksid |
| Kimyəvi formulu | O₄Ru[1] |
| Molyar kütlə | 165,07 q/mol |
| Fiziki xassələri | |
| Sıxlıq | 3,29 q/sm³ |
| Termik xüsusiyyətlər | |
| Ərimə nöqtəsi | 25,4; 25,5; 27 °S |
| Qaynama nöqtəsi | parçalanır 100 °S |
| Təsnifatı | |
| CAS-da qeyd. nöm. | 20427-56-9 |
| PubChem | 119079 |
| ChemSpider | 106401 |
Tarixi[redaktə | mənbəni redaktə et]
Rutenium (VIII) oksid ilk dəfə Karl Klaus tərəfindən 1860-cı ildə kəşf edilmişdir.
Fiziki xassələri[redaktə | mənbəni redaktə et]
Rutenum (VIII) oksid sarı-narıncı kristallar əmələ gətirir. Rutenium tetraoksid uçucu birləşmədir və asanlıqla sublimasiya olur. 100 ° C-dən çox qızdırıldıqda, partlayışla parçalanır. Güclü oksidləşdirici maddədir, ozon qoxusu verir, spirt ilə reaksiyaya daxil olduqda partlayış baş verir. Suda orta dərəcədə həll olunur, sulu məhlulları zəif bir turşudur pK1 =11.0.
Alınması[redaktə | mənbəni redaktə et]
- Rutenium qızdırıldıqda oksigenlə oksidləşir:
- Ruteniumun kalium bromat ilə oksidləşməsi nəticəsində:
- Rutenium(IV) oksidi qızdırılaraq parçalanması nəticəsində:
- Kalium tetroksarutenatın (VI) xlor ilə oksidləşməsindən:
Kimyəxi xassələri[redaktə | mənbəni redaktə et]
- Rutenum (VIII) oksid qızdırıldıqda parçalanır:
- Güclü oksidləşdiricidi. Xlorid turşusunun durulaşmış məhlulu ilə reaksiyaya daxil olur:
- Qələvilərlə reaksiyaya daxil olur:
Toksikliyi[redaktə | mənbəni redaktə et]
Rutenium tetroksid çox zəhərli, uçucu, güclü oksidləşdirici maddədir, buna görə möhürlənmiş ampulalarda saxlanmalıdır.
Mənbə[redaktə | mənbəni redaktə et]
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. .
- Неорганическая химия / под ред. Ю.Д. Третьякова. — М.: Академия, 2007. — Т. 3. — 400 с.
- ↑ Ruthenium tetroxide (ing.).






![{\displaystyle {\mathsf {RuO_{4}+10HCl\ \xrightarrow {} \ H_{2}[RuCl_{6}]+2Cl_{2}\uparrow +4H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/80e216134af91f9dc3d7aebf64760310536ab7fa)
![{\displaystyle {\mathsf {4RuO_{4}+32HCl\ {\xrightarrow {}}\ 2(RuCl_{3}\cdot RuCl_{4}]\downarrow +9Cl_{2}\uparrow +16H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/93dcea741dbb765d62d25da1acd765e7602ad6ba)


