Sulfit turşusu
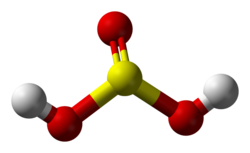
Sulfit turşusu – H2SO3 orta qüvvətli iki əsaslı turşudur, çox zəif, davamsız turşudur və ancaq duru məhlullarında mövcuddur. Qatı məhlullarında o, kükürd dioksidə və suya parçalanır.
| Sulfit turşusu | |
|---|---|
 | |
| Ümumi | |
| Sistematik adı | Sulfit turşusu |
| Kimyəvi formulu | H2SO3 |
| Molyar kütlə | 82,02 q/mol |
| Fiziki xassələri | |
| Sıxlıq | 1,03 q/sm³ |
Alınması
[redaktə | mənbəni redaktə et]Kükürd dioksidi suda həll etdikdə sulfit turşusu əmələ gəlir: SO2 + H2O ←→ H2SO3
Sulfit turşusu davamsız maddə olduğundan yalnız məhlulda mövcuddur.
Kimyəvi xassələri
[redaktə | mənbəni redaktə et]Suda iki mərhələdə dissosiyasiya edir:
- H2SO3 ←→ H++HSO3-
- HSO3←→H++SO32-
Və iki cür duz – sulfitlər və hidrosulfitlər əmələ gətirir:
- 2NaOH + H2SO3 →Na2SO3 + 2H2O
- NaOH + H2SO3 → NaHSO2 + H2O
Sulfit turşusu qüvvətli reduksiyaedicidir
H2SO3 + Cl2 + H2O → 2HCl + H2SO4
Çox qüvvətli reduksiyaedicilərlə H2SO3 özünü oksidləşdirici kimi aparır:
2H2S + H2SO3 → 3S↓ + 3H2O
Hidrosulfitləri qızdırdıqda pirosulfitə. Pirosulfit turşusu H2S2O5 (disulfit turşusu) sərbəst halda məlum deyil.
2KHSO3 → K2S2O5 + H2O
Polyar SO2 molekulları suda yaxşı həll olur.
Sulfit turşusu, kükürd dioksid kimi reduksiyaedici kimi xassəyə malikdir. Güclü reduksiyaedicilər iştirak etdikdə isə özünü oksidləşdirici kimi aparır.
Tətbiqi
[redaktə | mənbəni redaktə et]Sulfit turşusunun duzlarından Na2SO3 natrium-tiosulfatın alınmasında, NaHSO3 - ağardılmış parçadan xlorun artığının çıxarılmasında,həmçinin kalsium – hidrosulfitlə Ca(HSO3)2 birlikdə-oduncaqdan sellülozanın çıxarılmasında istifadə olunur.
İstinadlar
[redaktə | mənbəni redaktə et]- N.A. Verdizadə, K.Ə. Quliyev, Ş.Ə. Quliyev və b. Kimya kursu. Baki, 2010, səh. 210-217
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963