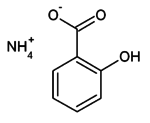
Ammonium Tiosulfat
Ammonium tiosulfat — (ammonium hiposülfit, ammonium turşusu) qeyri-üzvi birləşmə, (NH4)2SO3S düsturlu ammonium və tiosulfurik turşu duzudur, rəngsiz kristallardır, suda həll olunur. Fotoqrafiyada sürətli fiksatorların əsas komponenti kimi istifadə olunur.
== Alınması ==
Kükürd suspensiyasının ammonium hidrat məhlulu ilə yavaş reaksiyası:
4
(
N
H
3
⋅
H
2
O
)
+
4
S
→
(
N
H
4
)
2
S
O
3
S
+
2
N
H
4
H
S
+
H
2
O
{\displaystyle {\mathsf {4(NH_{3}\cdot H_{2}O)+4S\ {\xrightarrow {}}\ (NH_{4})_{2}SO_{3}S+2NH_{4}HS+H_{2}O}}}
Havada ammonium hidrosulfidin yavaş oksidləşməsi:
N
H
4
H
S
→
−
N
H
3
O
2
S
,
(
N
H
4
)
2
S
n
,
(
N
H
4
)
2
S
O
3
S
{\displaystyle {\mathsf {NH_{4}HS\ {\xrightarrow[{-NH_{3}}]{O_{2}}}\ S,(NH_{4})_{2}S_{n},(NH_{4})_{2}SO_{3}S}}}
Ammonium hidrosulfid və ammonium hidrosulfitin isti məhlullarının birləşdirilməsi:
2
N
H
4
H
S
+
4
N
H
4
H
S
O
3
→
80
o
C
3
(
N
H
4
)
2
S
O
3
S
+
3
H
2
O
{\displaystyle {\mathsf {2NH_{4}HS+4NH_{4}HSO_{3}\ {\xrightarrow {80^{o}C}}\ 3(NH_{4})_{2}SO_{3}S+3H_{2}O}}}
== Fiziki xüsusiyyətləri ==
Ammonium tiosulfat, ammonyak qoxusu olan, suda asanlıqla həll olunan, asetonda yüngül və etanolda həll olunmayan rəngsiz kristallar əmələ gətirir.
== Kimyəvi xüsusiyyətləri ==
Məhsul qarışığı meydana gətirmək üçün istilikdə parçalanır::
(
N
H
4
)
2
S
O
3
S
→
150
o
C
(
N
H
4
)
2
S
O
4
,
N
H
3
,
H
2
S
{\displaystyle {\mathsf {(NH_{4})_{2}SO_{3}S\ {\xrightarrow {150^{o}C}}\ (NH_{4})_{2}SO_{4},NH_{3},H_{2}S}}}
Seyreltilmiş məhlullarda yavaşca parçalanır::
(
N
H
4
)
2
S
O
3
S
→
τ
(
N
H
4
)
2
S
O
3
+
S
↓
{\displaystyle {\mathsf {(NH_{4})_{2}SO_{3}S\ {\xrightarrow {\tau }}\ (NH_{4})_{2}SO_{3}+S\downarrow }}}
Konsentrat turşuları ilə parçalanır:
(
N
H
4
)
2
S
O
3
S
+
2
H
C
l
→
2
N
H
4
C
l
+
S
O
2
↑
+
S
↓
+
H
2
O
{\displaystyle {\mathsf {(NH_{4})_{2}SO_{3}S+2HCl\ {\xrightarrow {}}\ 2NH_{4}Cl+SO_{2}\uparrow +S\downarrow +H_{2}O}}}
və isti seyreltilmiş turşular ilə:
(
N
H
4
)
2
S
O
3
S
+
2
H
C
l
+
H
2
O
→
100
o
C
2
N
H
4
C
l
+
H
2
S
O
4
+
H
2
S
↑
{\displaystyle {\mathsf {(NH_{4})_{2}SO_{3}S+2HCl+H_{2}O\ {\xrightarrow {100^{o}C}}\ 2NH_{4}Cl+H_{2}SO_{4}+H_{2}S\uparrow }}}
Halogenlərlə reaksiyaya girir::
(
N
H
4
)
2
S
O
3
S
+
4
C
l
2
+
5
H
2
O
→
2
N
H
4
C
l
+
2
H
2
S
O
4
+
8
H
C
l
{\displaystyle {\mathsf {(NH_{4})_{2}SO_{3}S+4Cl_{2}+5H_{2}O\ {\xrightarrow {}}\ 2NH_{4}Cl+2H_{2}SO_{4}+8HCl}}}
Natrium tiosulfat kimi, fotoşəkil materiallarını işləyərkən fiksasiya prosesinə imkan verən həll olunan komplekslər meydana gətirən gümüş halidləri ilə reaksiya verir. Natrium tiosulfatdan fərqli olaraq, bir litr məhlula 6 q gümüş konsentrasiyasına çatmağa imkan verən ammonium tiosulfat bu miqdarın demək olar ki, ikiqat artırılmasına imkan yaradır və bununla da reaktivlərin istehlakını azaldır. Fiksasiya prosesi natrium tiosulfatlı fiksatorlara nisbətən xeyli sürətlidir (bəzi emulsiyalar üçün% 50).
Bununla yanaşı, fiksatorlarda çox uzun müddət işləmək, aşağı gərginlikli yerlərdə metal gümüşün həll olunmasına,görüntü detalının itməsinə səbəb olur. Təsir xüsusilə incə dənəli emulsiyalarda və ammonium tiosulfatdakı sürətli fiksatorlarda (daha çox aktivliyi sayəsində) nəzərə çarpır ki, bu da işləmə prosesinin istilik və vaxt qaydalarına dəqiq əməl edilməsini tələb edir. Ayrıca, bu təsiri azaltmaq üçün filmlər və fotoqrafiya sənədləri üçün müxtəlif dərəcədə seyreltmədə sürətli fiksatorlar istifadə olunur; bu vəziyyətdə daha incə dənəli emulsiyaya sahib fotoqrafiya sənədləri üçün təxminən iki qat güclü seyreltmə tətbiq etmək lazımdır.
== Tətbiqi ==
Fiksasiya prosesini sürətləndirmək üçün sodium tiosulfat əvəzinə fotoqrafiyada fiksasiya həllərinin tərkib hissəsi kimi istifadə olunur.