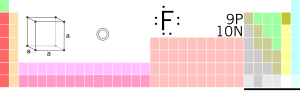
Flüor
Flüor (F) – D.İ. Mendeleyevin elementlərin dövri sistemində 9-cu elementdir. Atom radiusu qrupunun elementlərinə nisbətən kiçikdir, flüor atomu elektronu özünə daha güclü cəzb edir, yəni flüor kimyəvi cəhətdən daha aktivdir, oksidləşdiricilik qabiliyyəti daha yüksəkdir və elektromənfiliyi ən yüksək elementdir.
Flüor kimyəvi cəhətdən aktiv olduğuna görə yalnız birləşmələr şəklində rast gəlinir. Flüorun təbiətdə ən geniş yayılmış mineralı kalsium-Flüoriddir. Flüor müxtəlif dağ mədənlərinin tərkibində xüsusəndə apatitlərin tərkibində olur.
Kristal quruluşu-kub
Atom radiusu- 50 pm
Atom radiusu(hes.)- 42 pm
Kovalent radiusu-72 pm
Flüor yüksək aktivliyinə görə sərbəst halda ayrılması çətindir. Halogenlərdən yalnız flüor duzların ərintisinin elektrolizi ilə alınır. Onu, az miqdarda qurğuşun aparaturada biflüorid KF*HF ərintisinin elektrolizi ilə alırlar.
Flüor adi şəraitdə açıq sarı rəngli, xarakterik kəskin iyli qazdır. Flüor hətta adi şəraitdə belə su ilə şiddətli reaksiyaya girir və buna görə də onun suda məhlulunu almaq mümkün deyil.
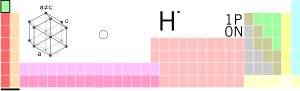
Hidrogen
Hidrogen (H) (yun. ὑδρογόνο tələffüzü idrogono – "su hazırlayan, su edən") — D. İ. Mendeleyevin dövri cədvəl sistemində 1-ci elementdir. Nisbi şəraitdə rəngsiz, qoxusuz, qeyri-metal, dadsız, asan yanan, havadan 14.5 dəfə yüngül, suda pis həll olan və H2 molekullarından ibarət qazdır. 1.00794 q/mol-a bərabər olan atom kütləsi ilə bütün elementlər arasında ən yüngül elementdir.
Hidrogen 1766-cı ildə İngilis fiziki və kimyaçısı Henri Kavendiş (1731–1810) tərəfindən kəşf edilmişdir. O, bunu "yanar qaz" adlandırmışdı. 1783-cü ildə suyu sintez edən Antuan-Loran Lavuazye "yanar qaza" hydrogene ("su əmələ gətirən") adını vermişdir. Rus dilində "водород" adını 1824-cü ildə kimyaçı M. F. Soloyov (1785–1856) təklif etmişdir.
Hidrogen kimyəvi elementlərin dövri sisteminin həm IA, həm də VIIA əsas yarımqrupunda yerləşir. Silisium və Bordan başqa digər qeyri metallarla +1 oksidləşmə dərəcəsi göstərdiyi üçün IA, Metallar, silisium və borla birləşmələrdə isə −1 oksidləşmə dərəcəsi göstərdiyi üçün VIIA yarımqrupunda yerləşir.

Litium flüor
Litium flüor (LiF) - litium və flüorun ikili kimyəvi birləşməsidir, flüorid turşununlitium duzu.
Normal şəraitdə litium flüor ağ tozdur və ya kub sisteminin şəffaf rəngsiz kristallarıdır, hüceyrə parametrləri a = 0,40279 nm, Z = 4.Suda zəif həll olunur (0 °C-də 0,120 q / 100 ml),
Temperatur artdıqca həllolma bir qədər artır(25 °C-də 0,134 q/100 ml; 35 °C-də 0,1357 q/100 ml).Standart şəraitdə istilik keçiriciliyi 4,01 Vt /(m K),
Litium floridin zəif həll olmasından istifadə edərək, mübadilə reaksiyaları ilə almaq olar:
L
i
C
l
+
N
H
4
F
→
L
i
F
↓
+
N
H
4
C
l
{\displaystyle {\mathsf {LiCl+NH_{4}F\ {\xrightarrow {\ }}\ LiF\downarrow +NH_{4}Cl}}}
Litium hidroksid və flüorid turşunun qarşılıqlı təsiri ilə də əldə edilə bilər:
L
i
O
H
+
H
F
→
L
i
F
↓
+
H
2
O
{\displaystyle {\mathsf {LiOH+HF\ {\xrightarrow {\ }}\ LiF\downarrow +H_{2}O}}}
Flüorid turşusunun qatı məhlullarında həll olunur:
L
i
F
+
H
F
→
L
i
H
F
2
{\displaystyle {\mathsf {LiF+HF\ {\xrightarrow {\ }}\ LiHF_{2}}}}
L
i
F
+
H
2
S
O
4
→
L
i
H
S
O
4
+
H
F
↑
{\displaystyle {\mathsf {LiF+H_{2}SO_{4}\ {\xrightarrow {\ }}\ LiHSO_{4}+HF\uparrow }}}
L
i
F
+
H
N
O
3
→
L
i
N
O
3
+
H
F
↑
{\displaystyle {\mathsf {LiF+HNO_{3}\ {\xrightarrow {\ }}\ LiNO_{3}+HF\uparrow }}}
Qatı qüvvətli turşularda həll olunur:
2
L
i
F
+
C
a
O
→
600
o
C
L
i
2
O
+
C
a
F
2
{\displaystyle {\mathsf {2\ LiF+CaO\ {\xrightarrow {600^{o}C}}\ Li_{2}O+CaF_{2}}}}
2
L
i
F
+
C
a
(
O
H
)
2
→
2
L
i
O
H
+
C
a
F
2
↓
{\displaystyle {\mathsf {2\ LiF+Ca(OH)_{2}\ {\xrightarrow {\ }}\ 2\ LiOH+CaF_{2}\downarrow }}}
Litium flüorid çox yüksək şəffaflığa malikdir ultrabənövşəyidən infraqırmızı spektral diapazona qədər (0,12 ... 6 mikron), buna görə də o, ultrabənövşəyi (vakuum ultrabənövşəyi daxil olmaqla hansınınki şəffaflığı bütün digər optik materiallardan üstündür) və infraqırmızı optikada istifadə olunur.Bundan əlavə, termolüminessent dozimetriya ilə radiasiya dozalarını ölçmək üçün istifadə olunur.
Yüksək ərimə istiliyi olduğundan (1044 kJ/kq) istilik enerjisinin saxlanması üçün istifadə olunur. Əridikdə həcmini 22% artırır. Maye litium flüoridin təsirindən metallar tez zamanda korroziyaya uğrayır.
Litium flüorid zəhərlidir. Havada maksimum icazə verilən konsentrasiya 1 mq/m³ təşkil edir.
Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., — М.—Л.: Химия, 1966.

Hidrogen azid
Əsas təhlükələr Yüksək zəhərli, partlayıcı, reaktiv
Hidrogen azid və ya azoimid kimi tanınan, HN3 kimyəvi formulu olan birləşmədir.[3] Otaq temperaturunda rəngsiz, uçucu və partlayıcı mayedir. Azot və hidrogenin birləşməsidir və buna görə də pniktogen hidridi adlanır. İlk dəfə 1890-cı ildə Teodor Kurtius tərəfindən alınmışdır.[4] Turşunun az tətbiqi var, lakin onun konjugat əsası, azid ionu xüsusi proseslərdə faydalıdır.
Hidrogen azid digər mineral turşular kimi suda həll olur. Durulaşdırılmamış hidrogen azid təhlükəli partlayıcıdır[5], standart əmələ gəlmə entalpiyası ΔsHo (l, 298K) = +264 kCmol-1. [6] Durulaşdıqda, qaz və sulu məhlullar (<10%) təhlükəsiz hazırlana bilər, lakin dərhal istifadə edilməlidir; aşağı qaynama nöqtəsinə görə hidrogen azid buxarlanma və kondensasiya zamanı qatılaşır ki, partlamayan durulaşdırılmış məhlullar konteynerin və ya reaktorun yuxarı hissəsində partlaya bilən damcılar əmələ gətirə bilər.[7] [8]
Mündəricat
Turşu adətən natrium azid kimi bir azid duzunun turşulaşdırılması nəticəsində əmələ gəlir. Natrium azidin suda məhlulları azid duzu ilə tarazlıqda olan az miqdarda hidrogen aziddən ibarət olur, lakin daha güclü bir turşunun tətbiqi məhluldakı əsas qrupları hidrogen azid turşusuna çevirə bilər. Saf turşu sonradan son dərəcə partlayıcı və rəngsiz maye kimi fraksiyalı distillə ilə əldə edilə bilər.[2]
NaN3 + HCl → HN3 + NaCl
Həmçinin onun sulu məhlulu həll olmayan barium sulfatın əlavə olunması ilə əldə olunmuş barium azid məhlulunu duru sulfat turşusu ilə reaksiyası ilə də hazırlana bilər.[9]
Hidrogen azid əvvəlcə hidrazinin nitrit turşusu ilə reaksiyasından alınmışdır:
N2H4 + HNO2 → HN3 + 2 H2O
Hidrazinium kationu [N2H5]+ ilə bu reaksiya aşağıdakı kimi yazılır:
[N2H5]+ + HNO2 → HN3 + H2O + [H3O]+
Hidrogen peroksid, nitrosilxlorid, trixloramin və ya nitrit turşusu kimi digər oksidləşdirici maddələr də hidrazindən hidrogen azid almaq üçün istifadə edilə bilər.[10]
Utilizasiyadan əvvəl məhv edilməsi
Hidogen azid turşusu nitrit turşusu ilə reaksiyaya daxil olur:
HN3 + HNO2 → N2O + N2 + H2O
Bu reaksiya qeyri-adidir, ona görə ki, o, dörd müxtəlif oksidləşmə vəziyyətində azotlu birləşmələri əhatə edir.[11]
Öz xüsusiyyətlərinə görə hidrogen azid turşusu halogen turşulara bənzəyir, çünki o, zəif həll olan (suda) qurğuşun, gümüş və civə (I) duzlarını əmələ gətirir. Metal duzların hamısı susuz formada kristallaşır və qızdırıldıqda parçalanır və təmiz metalın qalığı qalır.[2] O, zəif turşudur (pKa = 4,75.[6]) Onun ağır metal duzları partlayıcıdır və alkil yodidlərlə asanlıqla qarşılıqlı təsirdə olur. Daha ağır qələvi metalların (litium istisna olmaqla) və ya qələvi torpaq metallarının azidləri partlayıcı deyil, lakin qızdırıldıqda daha idarə olunan şəkildə parçalanır və spektroskopik cəhətdən təmiz N2 qazı alınır.[12] Hidrogen azid turşusunun məhlulları hidrogenin ayrılması və azidlər (əvvəllər azoimidlər və ya hidrazoatlar) adlanan duzların əmələ gəlməsi ilə bir çox metalı (məsələn, sink, dəmir) həll edir.

Hidrogen bombası
Hidrogen bombası — Nüvə silahının növü.
Hidrogen bombası atom bombasından qat-qat güclüdür.Hidrogen bombasında reaksiyanın başlaması üçün atom bombasından istifadə edilir.
Hidrogen enerjisi
Hidrogen iqtisadiyyatı, Hidrogen enerjisi - önümedilməkdədir.
Bu enerji, sudan əldə edilə bilməkdə və yüksək məhsuldarlıqla, ətraf üzərində heç bir mənfi təsir yaratmadan faydalı bir enerjiyə çevrilə bilməkdədir. Dünyanın enerji problemini həll etmək üçün istifadə ediləcək hidrogen enerjisi ilə milyardlarla il çatacaq enerji davamlı olaraq çıxarıla biləcək.
Yaponiyanın “JR Higashi Nihon” dəmir yolu şirkəti 2020-ci ilin ortalarından başalayaraq ekoloji cəhətdən təmiz, hidrogen yanacağı elementindən istifadə edən qatarlardan istifadəni planlaşdırır. Şirkət hidrogen yığılan çənlərin vaqonların damında və döşəmənin altında yerləşdirilməsini nəzərdə tutan layihə üzərində işləyir. Həmin qatarlarda elektrik enerjisi çənlərdəki hidrogenin atmosferdəki oksigenlə kimyəvi reaksiyası zamanı əldə ediləcək. Hesablamalara görə, qatarlardakı bütün çənlər dolu olduğu halda onun təqribən 140 kilometr məsafəni qət etməsi mümkündür.
Hidrogen peroksid
{{Hidrogen peroksid, başqa sözlə, oksigenli su, maye sudan daha sıx olan maye komponentdir. Bu komponent həm də çox yaxşı oksidləşdirici kimi tanınır. Hidrogen peroksid daha çox təmizləmək, infeksiyanın qarşısını almaq, dezinfeksiya etmək və açıq yaraları sağaltmaq üçün istifadə olunur. Ancaq bunun daha çox istifadəsi var. Burada bütün detallar var. Hidrogen peroksid ilk yardımdan daha çox şeydir. Möhtəşəm dezinfeksiyaedici xüsusiyyətə malik olan hidrogen peroksid hər evdə olması lazım olan möcüzəvi tərkib hissəsidir. Hidrogen peroksidin istifadəsi nədir? Hidrogen peroksidin bir çox istifadəsi var. Böyük bir dezinfeksiyaedici xüsusiyyətə malik olan bu komponent oksigen atomlarını ehtiva edir və yalnız apteklərdən əldə edilə bilər.

Hidrogen rabitəsi
Hidrogen rabitəsi — oriyentasiya qüvvəsinin xüsusi növüdür. Flüor, oksigen və yaxud azot atomuna birləşmiş hidreogen atomu ilə flüor, oksigen və yaxud azot atomu arasında yaranan oriyentasiya qüvvəsinə hidrogen rabitəsi deyilir.
hidrogen ionu (H+) heç bir elektronu olmayan və +1 yükə malik nüvədən ibarətdir. Buna görə onu bəzən "çılpaq" proton da adlandırırlar. Elektrona malik olmadığı üçün hidrogen ionunun müsbət yükü mənfi yüklü ionlar tərəfindən güclü surətdə cəzb olunur. Bununla əlaqədar olaraq, bir sıra molekullarda xüsusi təbiətə malik rabitə növü meydana çıxır ki, bu da bir qayda olaraq, hidrogenin iştirakı ilə əmələ gəldiyi üçün hidrogen rabitəsi adlanır..
h2o
Hidrogen rabitəsi bilavasitə hidrogen ilə elektromənfiliyi yüksək olan elementlər (F,O,N və s.) arasında meydana çıxır. Məsələn, HF qaz halda polimerləşərək bir sıra polimerlər şəklində mövcud olur:H2F2, H3F3, H4F4, H5F5, H6F6 və s.
Hidrogen rabitəsi adətən üç nöqtə ilə işarə edilir.
Adi temperaturda H2O maye, H2S isə qazdır.

Hidrogen tsikli
Hələ 1950-ci ildə Beyts və Nikole hidroksil radikalının ozon ilə reaksiyaya girərərək və sonra regenerasiya olunması ilə ozonun parçalanmasının mümkünlüyünü söyləmişdir:
HO•+ O3 → HO•2 + O2
HO•2 + O• → HO•2 + O2
Stratosferdə hidroksil radikalları su, hidrogen və metan molekullarından əmələ gəlir. Su molekulu günəşin ultrabənövşəyi radiasiyasının təsiri ilə fotodissosiasiya olunur, H2 və metan isə O (1D) vəziyyətində olan atomar oksigen reaksiyaya girir:
H2 + O(1D) → HO• + H
H•+ O2 + M → HO•2 + M
CH4 + O(1D) → C•H3 + HO•
HO• radikallarının hesablanan qatılığı təxminən 40 km hündürlükdə maksimuma çatır. Hidrogen tsikllindəki ozon ilə hidroksil radikalının reaksiyası radikalların məhv olması nəticəsində pozulur:
HO•+ HO•2 → H2O + O2
HO•2 + HO•2 → H2O2 + O2
Lakin, HO• radikalları məhv olana qədər hündürlükdən asılı olaraq15-dən 110-a qədər ozon molekulunu parçalaya bilirlər.
V.M. Abbasov, R.Ə. Əliyeva, N.Ə.Səlimova, M.M Abbasov. Ekoloji kimya 2003.

Metallik hidrogen
Metallik hidrogen — həddindən artıq yüksək təzyiqdə və faza keçidində olan hidrogenin fazalı vəziyyətlərinin məcmusudur. Metallik hidrogen maddənin pozulmuş bir vəziyyətidir və bəzi fərziyyələrə görə müəyyən spesifik xüsusiyyətlərə malik ola bilər — yüksək temperaturda yüksək keçiricilik və faza keçidinin yüksək spesifik istiliyi. 1935-ci ildə nəzəri olaraq proqnozlaşdırıldı.
1930-cu illərdə İngilis alimi C. Bernal, bir proton və bir elektrondan ibarət olan və qələvi metalların tam bir analoqunu təmsil edən atom hidrogeninin yüksək təzyiqlərdə sabit ola biləcəyini irəli sürdü. 1935-ci ildə Y. Viqner və H. B. Hantinqton müvafiq hesablamalar apardılar. Bernalın fərziyyəsi təsdiqləndi — hesablamalara görə, molekulyar hidrogen, sıxlığının əhəmiyyətli dərəcədə artması ilə təxminən 250 min atmosfer təzyiqində (25 GPa) atom metal fazasına keçir. Sonradan, faza keçidi üçün tələb olunan təzyiqin qiymətləndirilməsi artırıldı, lakin keçid şərtləri hələ də mümkün olan hesab olunur. Metal hidrogenin xüsusiyyətlərinin proqnozu nəzəri olaraq həyata keçirilir. 1970-ci illərdə başlayan cəhdlər, 1996, 2008 və 2011-ci illərdə mümkün olan hidrogen epizodlarına səbəb oldu, nəhayət, 2017-ci ildə professor İsaak Silvera və həmkarı Ranqa Diaz 5 milyon atmosfer təzyiqində sabit bir nümunə əldə etdilər, lakin nümunənin saxlanıldığı otaq təzyiq altında çökdü və nümunə itirildi.
Nəhəng planetlərin — Yupiter, Saturn — və böyük ekzoplanetlərin nüvələrində çox miqdarda metal hidrogenin olduğuna inanılır.

Flüor tərkibli monomerlər
Aromatik poliamidlərin sintezində istifadə olunan monomerlər
Tere- və izoftar turşularından alınan aromatik poliamidlər alifatik poliamidlərdən (məsələn, poliamid-6 və -6,6) daha yüksək ərimə temperaturuna malik olması ilə fərqlənir: bir qayda olaraq bu göstərici 573 K-dən yüksək olur. Belə ki, tereftal turşusunun N,N-difenil-p- fenilendiaminlə kondensləşməsi zamanı ərimə temperaturu 663 K olan lifəmələgətirən polimer alınır. Tereftal turşusu ilə pepetazindən alınan lifəmələgətirən polimerin ərimə temperaturu 623-673 K-dir.
Tereftal turşusundan alınan poliamidlər izoftal turşusu əsasında poliamidlərlə müqayisədə daha yüksək ərimə temperaturuna malikdir. Məsələn, 2,5-dimetilpiperazinin (trans-forma) vakumda tereftal turşusu ilə qarşılıqlı təsirdən parçalanma temperaturu 673 K-dən yüksək olan lifəmələgətirən polimer alınır. İzoftal turşusu əsasında hazırlanmış analoji polimer 588 K ərimə temperaturuna malikdir. Tereftal turşusu ilə 4,4-diaminditsikloheksilmetandan sintez olunmuş lifəmələgətirən polimer 648 K-də əriyir. İzoftal turşusunun müvafiq polimerinin ərimə temperaturu 473 K-ə bərabərdir.
Aromatik dikarbon turşuları ilə piperazinlərdən polimerlərin alınmasında müvafiq turşulardan və yaxud onların törəmələrindən: efirlər, anhidridlər, xloranhidridlər, amidlərdən istifadə olunur. Tsikloalifatik diaminlərdən poliamidlər sintez etmək üçün turşulardan, aromatik diaminlərdən sintez üçün isə turşuların xloranhidridlərindən istifadə edilir.

Kripton (II)flüor
Kripton (II) flüor KrF2 — uçucu rəngsiz kristallardı, kriptonun ilk açıq birləşməsidir. Kimyəvi aktiv maddədir. Yüksək temperaturda flüor və kriptona parçalanır.
Kripton (II) flüor iki kristal modifikasiyadan birində mövcud ola bilər: α-forma və β-forma. β-KrF2 −80 °C-dən yuxarı temperaturda sabitdir. Aşağı temperaturda α-forma sabitdir.
Kripton (II) flüoru sadə maddələrdən bir çox yolla almaq olar. Aşağıda birləşmənin alınma sürətini artırmaq üçün KrF2-nin sintezi üsulları verilmişdir. Ümumi reaksiya sxemi aşağıdakı kimidir:
K
r
+
F
2
→
K
r
F
2
{\displaystyle {\mathsf {Kr+F_{2}\rightarrow KrF_{2}}}}
Bu üsul nəticəsində həm də kripton tetraflüor alınır. Flüor və kripton qarışığının 1: 1 və 1: 2 nisbətində, 40-dan 60 mm.c.st təzyiq altında güclü elektrik boşalması ilə (cərəyan şiddəti 30 mA, gərginlik 500–1000 V) aktivləşdirilir.

Hidrogen-sulfid qazı
Hidrogen-sulfid qazı (H2S) - rəngsiz, kəskin iyli, suda yaxşı həll olan yanar qaz. Sıxlığı 1,538 q/l; hidrogen-sulfid qazı yüksək dərəcədə zəhərlidir. Havada ehtimal olunan miqdarı 0,01mq/l-ə yaxındır. Sərbəst halda biokimyəvi mənşəli təbii qazlarda (~1% yaxın), metamorfik və maqmatik qazlarda və həmçinin fumarollarda rast gəlinir. Təbii qazlarda hidrogen-sulfid qazı miqdarı, adətən 1%-dən çox olmur. Karbonat süxurların üstünlük təşkil etdiyi, xüsusilə sulfat mineralları ilə zəngin olan kəsilişlərin sularında həll olmuş hidrogen-sulfid qazı miqdarı yüksək olur.
Hava
Təbii qaz
Fumarollar
Geologiya terminlərinin izahlı lüğəti. — Bakı: Nafta-Press, 2006.
Hidrogen yanacağı enerjisi
Hidrogen iqtisadiyyatı, Hidrogen enerjisi - önümedilməkdədir.
Bu enerji, sudan əldə edilə bilməkdə və yüksək məhsuldarlıqla, ətraf üzərində heç bir mənfi təsir yaratmadan faydalı bir enerjiyə çevrilə bilməkdədir. Dünyanın enerji problemini həll etmək üçün istifadə ediləcək hidrogen enerjisi ilə milyardlarla il çatacaq enerji davamlı olaraq çıxarıla biləcək.
Yaponiyanın “JR Higashi Nihon” dəmir yolu şirkəti 2020-ci ilin ortalarından başalayaraq ekoloji cəhətdən təmiz, hidrogen yanacağı elementindən istifadə edən qatarlardan istifadəni planlaşdırır. Şirkət hidrogen yığılan çənlərin vaqonların damında və döşəmənin altında yerləşdirilməsini nəzərdə tutan layihə üzərində işləyir. Həmin qatarlarda elektrik enerjisi çənlərdəki hidrogenin atmosferdəki oksigenlə kimyəvi reaksiyası zamanı əldə ediləcək. Hesablamalara görə, qatarlardakı bütün çənlər dolu olduğu halda onun təqribən 140 kilometr məsafəni qət etməsi mümkündür.