



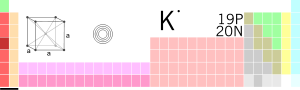




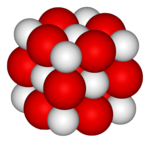















I сущ. хим. кадмий: 1. химический элемент, серебристо-белый мягкий металл 2. искусственная желтая краска разных оттенков II прил. кадмиевый. Kadmium a
Полностью »[lat.] kim. 1. Sink filizlərinin tərkibində olan gümüşü-ağ yüngül metal; kimyəvi element. 2. Müxtəlif çalarları olan süni sarı boya
Полностью »[lat.] хим. кадмий (1. цӀарцӀар гудай лацу-гимишдин ранг алай хъуьтуьл металл; химиядин элемент; 2. гьа металлдикай авур хъипи ранг).
Полностью »м kadmium (1. parlaq ağ metal: kimyəvi element; 2. bu metaldan alınan rənglərin adı).
Полностью »[lat.] kim. Əhəngdaşı, mərmər və s. tərkibində olan gümüşü-ağ rəngli metal – kimyəvi element
Полностью »...калию, содержащий в себе калий). Kalium şorası калиевая селитра, kalium zəyi калиевые квасцы 2. калийный. Kalium gübrəsi почв. калийное удобрение
Полностью »-я; м. (лат. cadmium из греч. kadmeia - цинковая руда) см. тж. кадмиевый 1) Химический элемент (Cd), серебристо-белый мягкий, тягучий металл, содержащ
Полностью »мн. нет кадмий (1. цIар-цIар гудай лацу хъуьтуьл металл. 2. гьа металлдикай авур хъипи ранг).
Полностью »[lat. əsli ər. əlkali] kim. Qələvi filizlər qrupundan gümüşü-ağ rəngli metal – kimyəvi element
Полностью »ср xüs. kadmiumlama (dəmir və ya poladın üzərinə elektriklə kadmium çəkmə).
Полностью »möhkəm, bərk, davamlı, dözümlü, etibarlı; къадим цал möhkəm divar; * къадим авун bax къадимарун; къадим хьун möhkəmlənmək, bərkimək, davamlı olmaq, dö
Полностью »möhkəm, bərk, davamlı, dözümlü, etibarlı; къадим цал möhkəm divar; * къадим авун bax къадимарун; къадим хьун möhkəmlənmək, bərkimək, davamlı olmaq, dö
Полностью »1) adj. ancient, antique; early; venerable; 2) adj. enduring, lasting; solid, reliable; stable, steady
Полностью »1) adj. ancient, antique; early; venerable; 2) adj. enduring, lasting; solid, reliable; stable, steady
Полностью »...тӀвар жедач. Чун паталди а пак затӀар лагьайтӀа, чи бубайрин къадим дин я, иман я, Ягь-намус я, лишанар тир паквилин. А. Къ. Ярагъ Мегьамедан гьаза
Полностью »1.1. древний, давний : къадим чӀавар - древние времена; лап къадим чӀавалай инихъ - с древних времён, издревле, издавна. 1.2. прочный, рассчитанный на
Полностью »sif. kim. Kalium qarışdırmaqla hazırlanmış, tərkibində kalium olan. Kaliumlu duzlar.
Полностью »[lat. radiare] хим. радий (гимишдин-лацу ранг алай радиоактивный металл, химиядин элемент).
Полностью »I. i. kim. radium II. s. kim. radium; ~ bromid radium bromide; ~ karbonat radium carbonate; ~ xlorid radium chloride; ~ sulfat radium sulfate
Полностью »...(химический элемент, металл, обладающий радиоактивными свойствами). Radium-xlorid хлористый радий (хлорид радия)
Полностью »ж 1. мн. нет къадим замандинди хьунухь; куьгьневал. 2. къадим заман, куьгьне заман. 3. къадим замандилай амай шей.
Полностью »сущ. от глаг. kadmiumlamaq, тех. кадмирование (процесс нанесения антикоррозийного кадмиевого покрытия на поверхность стальных изделий)
Полностью »























