

















...содержащий хлор) 2. хлорный (содержащий хлор). Xlorlu əhəng хлорная известь, xlorlu su хлорная вода
Полностью »s. kim. chlorous, chloric, chlorinated; ~ əhəng chloride of lime, bleaching powder; ~ turşu chlorous acid
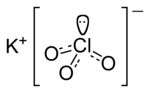
Полностью »прил. kim. 1. xlor -i[-ı]; хлорная кислота xlor turşusu; 2. xlorlu; хлорная известь xlorlu əhəng.
Полностью »сущ. хим., геол. хлорит; xloritlər хлориты: 1. группа слюдоподобных минералов зеленоватого цвета, входящих в состав многих горных пород 2
Полностью »[yun.] бот. хлороз (набататрин пешерик ва кьенерик къацу ранг тахьун; набататрин азар).
Полностью »I прил. хуторный, хуторской (живущий в хуторе) II сущ. хуторянин, хуторянка (житель хутора)
Полностью »прил. 1. хромовый (содержащий хром). Xromlu boyalar хромовые краски, xromlu filiz хромовая руда 2. хромистый (содержащий хром). Xromlu polad хромистая
Полностью »сущ. бот. хлороз: 1. болезнь растений, при которой нарушается образование хлорофилла в листьях, появляется желтизна 2
Полностью »...элементами) II прил. хлористый. Mis 1-xlorid хлористая медь (I), civə 1-xlorid хлористая ртуть (I), qızıl 1-xlorid хлористое золото (I), qalay 2-xlor
Полностью »сущ. хим. хлорал (бесцветная маслянистая жидкость с резким запахом, получаемая хлорированием спирта, наркотическое и болеутоляющее средство)
Полностью »[yun.] bot. Bitkilərdə: yarpaqlarda və zoğlarda yaşıl rəngin çatışmazlığından törəyən xəstəlik hal
Полностью »...пламенный: 1. ярко горящий, пылающий 2. перен. пылкий, страстный. Alovlu vətənpərvər пламенный патриот, alovlu nitq пламенная речь, alovlu şeirlər пл
Полностью »...размножается при помощи спор. Sporlu bitkilər споровые растения, sporlu bakteriyalar споровые бактерии 2. такой, который осуществляется при помощи сп
Полностью »s. 1. flaming, fiery; 2. məc. ardent, flam ing, passionate, fervent; ~ baxış fiery glance; ~ vətənpərvərlik ardent / flaming patriotism; ~ vətənpərvər
Полностью »sif. 1) adj ardent,-e ; chaleureu//x,-se ; enflammé, -e ; fougueu//x,-s ; flambant, -e ; 2) adv ardemment ; chaleuresement ; d’une manière fougueuse ;
Полностью »is. tik. par blocs, par éléments préfabriqués ; ~ tikinti construction f faite par des éléments préfabriqués
Полностью »прил. 1. куькӀвена ккузвай, ялав акъатзавай, ялав квай; 2. пер. ялавлу, чими (мес. саламар, гафар); // хъиляй яп-яру хьайи (мес
Полностью »i. tik. sectional; panel (attr.); ~ tikinti building of sectional houses; ~ evlər frame - and- panel houses
Полностью »...atəşin, ehtiraslı, coşqun. Alovlu salamlar. Alovlu nitq. Alovlu sözlər. Alovlu baxışlar. // Hiddətdən qıpqırmızı olmuş. Bu halda [Toğrulun] alovlu gö
Полностью »...içində, ehtiyatla. Mağaza işçiləri qəzet parçasına xoflu-xoflu baxıb başlarını buladılar. H.Seyidbəyli.
Полностью »...боязливый, пугливый 2. страшный, наводящий страх 3. испуганный. Xoflu gözlər испуганные глаза
Полностью »sif. Xovu olan, üstü xovla örtülü. Xovlu xalça. Xovlu parça. Xovlu dəsmal. – Xovlu fərməş bir neçə yerdən didilibyeyilmişdi, elə bil güvənin ağzından
Полностью »прил. 1. ворсистый (покрытый ворсом, ворсинками). Xovlu adyal ворсистое одеяло, xovlu xalça ворсистый ковер 2. ворсовой, ворсовый (с ворсом). Xovlu pa
Полностью »...və zərf 1. Xof içində, təlaş içində, şübhə içində; şübhəli. Xoflu adam. – Xain xoflu olar. (Ata. sözü). Şahmar bəy gedəndən bir az sonra Fərhad və Mə
Полностью »[lat.] əcz. Xlorlu kalsium və urotropin duzu (qripin qabağını almaq üçün dərman kimi işlənir).
Полностью »tərkibində yeyilməyə qarşı aşqar (kükürdlü və xlorlu üzvi birləşmələr və s.) olan neft yağları.
Полностью »...(parçanı ağartmaq, ləkə aparmaq və dezinfeksiya üçün işlədilən xlorlu məhlul).
Полностью »