I
сущ. хим. аммоний (соединение азота и водорода, не встречающееся в свободном состоянии)
II
прил. аммониевый, аммонийный. Ammonium birləşmələri аммониевые соединения, ammonium şorası аммонийная селитра

Ammonium Tiosulfat
Ammonium tiosulfat — (ammonium hiposülfit, ammonium turşusu) qeyri-üzvi birləşmə, (NH4)2SO3S düsturlu ammonium və tiosulfurik turşu duzudur, rəngsiz kristallardır, suda həll olunur. Fotoqrafiyada sürətli fiksatorların əsas komponenti kimi istifadə olunur.
== Alınması ==
Kükürd suspensiyasının ammonium hidrat məhlulu ilə yavaş reaksiyası:
4
(
N
H
3
⋅
H
2
O
)
+
4
S
→
(
N
H
4
)
2
S
O
3
S
+
2
N
H
4
H
S
+
H
2
O
{\displaystyle {\mathsf {4(NH_{3}\cdot H_{2}O)+4S\ {\xrightarrow {}}\ (NH_{4})_{2}SO_{3}S+2NH_{4}HS+H_{2}O}}}
Havada ammonium hidrosulfidin yavaş oksidləşməsi:
N
H
4
H
S
→
−
N
H
3
O
2
S
,
(
N
H
4
)
2
S
n
,
(
N
H
4
)
2
S
O
3
S
{\displaystyle {\mathsf {NH_{4}HS\ {\xrightarrow[{-NH_{3}}]{O_{2}}}\ S,(NH_{4})_{2}S_{n},(NH_{4})_{2}SO_{3}S}}}
Ammonium hidrosulfid və ammonium hidrosulfitin isti məhlullarının birləşdirilməsi:
2
N
H
4
H
S
+
4
N
H
4
H
S
O
3
→
80
o
C
3
(
N
H
4
)
2
S
O
3
S
+
3
H
2
O
{\displaystyle {\mathsf {2NH_{4}HS+4NH_{4}HSO_{3}\ {\xrightarrow {80^{o}C}}\ 3(NH_{4})_{2}SO_{3}S+3H_{2}O}}}
== Fiziki xüsusiyyətləri ==
Ammonium tiosulfat, ammonyak qoxusu olan, suda asanlıqla həll olunan, asetonda yüngül və etanolda həll olunmayan rəngsiz kristallar əmələ gətirir.
== Kimyəvi xüsusiyyətləri ==
Məhsul qarışığı meydana gətirmək üçün istilikdə parçalanır::
(
N
H
4
)
2
S
O
3
S
→
150
o
C
(
N
H
4
)
2
S
O
4
,
N
H
3
,
H
2
S
{\displaystyle {\mathsf {(NH_{4})_{2}SO_{3}S\ {\xrightarrow {150^{o}C}}\ (NH_{4})_{2}SO_{4},NH_{3},H_{2}S}}}
Seyreltilmiş məhlullarda yavaşca parçalanır::
(
N
H
4
)
2
S
O
3
S
→
τ
(
N
H
4
)
2
S
O
3
+
S
↓
{\displaystyle {\mathsf {(NH_{4})_{2}SO_{3}S\ {\xrightarrow {\tau }}\ (NH_{4})_{2}SO_{3}+S\downarrow }}}
Konsentrat turşuları ilə parçalanır:
(
N
H
4
)
2
S
O
3
S
+
2
H
C
l
→
2
N
H
4
C
l
+
S
O
2
↑
+
S
↓
+
H
2
O
{\displaystyle {\mathsf {(NH_{4})_{2}SO_{3}S+2HCl\ {\xrightarrow {}}\ 2NH_{4}Cl+SO_{2}\uparrow +S\downarrow +H_{2}O}}}
və isti seyreltilmiş turşular ilə:
(
N
H
4
)
2
S
O
3
S
+
2
H
C
l
+
H
2
O
→
100
o
C
2
N
H
4
C
l
+
H
2
S
O
4
+
H
2
S
↑
{\displaystyle {\mathsf {(NH_{4})_{2}SO_{3}S+2HCl+H_{2}O\ {\xrightarrow {100^{o}C}}\ 2NH_{4}Cl+H_{2}SO_{4}+H_{2}S\uparrow }}}
Halogenlərlə reaksiyaya girir::
(
N
H
4
)
2
S
O
3
S
+
4
C
l
2
+
5
H
2
O
→
2
N
H
4
C
l
+
2
H
2
S
O
4
+
8
H
C
l
{\displaystyle {\mathsf {(NH_{4})_{2}SO_{3}S+4Cl_{2}+5H_{2}O\ {\xrightarrow {}}\ 2NH_{4}Cl+2H_{2}SO_{4}+8HCl}}}
Natrium tiosulfat kimi, fotoşəkil materiallarını işləyərkən fiksasiya prosesinə imkan verən həll olunan komplekslər meydana gətirən gümüş halidləri ilə reaksiya verir. Natrium tiosulfatdan fərqli olaraq, bir litr məhlula 6 q gümüş konsentrasiyasına çatmağa imkan verən ammonium tiosulfat bu miqdarın demək olar ki, ikiqat artırılmasına imkan yaradır və bununla da reaktivlərin istehlakını azaldır. Fiksasiya prosesi natrium tiosulfatlı fiksatorlara nisbətən xeyli sürətlidir (bəzi emulsiyalar üçün% 50).
Bununla yanaşı, fiksatorlarda çox uzun müddət işləmək, aşağı gərginlikli yerlərdə metal gümüşün həll olunmasına,görüntü detalının itməsinə səbəb olur. Təsir xüsusilə incə dənəli emulsiyalarda və ammonium tiosulfatdakı sürətli fiksatorlarda (daha çox aktivliyi sayəsində) nəzərə çarpır ki, bu da işləmə prosesinin istilik və vaxt qaydalarına dəqiq əməl edilməsini tələb edir. Ayrıca, bu təsiri azaltmaq üçün filmlər və fotoqrafiya sənədləri üçün müxtəlif dərəcədə seyreltmədə sürətli fiksatorlar istifadə olunur; bu vəziyyətdə daha incə dənəli emulsiyaya sahib fotoqrafiya sənədləri üçün təxminən iki qat güclü seyreltmə tətbiq etmək lazımdır.
== Tətbiqi ==
Fiksasiya prosesini sürətləndirmək üçün sodium tiosulfat əvəzinə fotoqrafiyada fiksasiya həllərinin tərkib hissəsi kimi istifadə olunur.
Ammonium duzları
Ammonium duzları - bərk, əsasən ağ rəngli, suda yaxşı həll olan kristal maddələrdir.
== Alınması ==
Ammonium duzları ammonyakın və ya ammonium hidroksidin turşularla qarşılıqlı təsirindən alınır:
NH3 + HCl → NH4Cl
H2SO4 + 2(NH3*H2O) → (NH4)2SO4 + 2H2O
2. Ammonyakın xlorla qarşılıqlı təsirindən alınır:
8NH3 + 3Cl2 → N2↑ + 6NH4Cl
== Fiziki xassələri ==
Tərkibində -NH4+ olan ammonium duzları rənginə və bəzi digər xassələrinə gorə natrium duzlarına oxşayır. Ammonium duzları suda yaxşı həll olur . Su məhlulunda tamamilə dissosiasiya edir. İylidir.
NH3 +H2O ↔ NH3H2O ↔ NH4+ OH-
Bu reaksiya dönəndir, ona görə də sulu məhlulda ammonium hidroksid ammonyakla eyni tarazlıqdadır.
Ammonium duzları duzlara məxsus xassələri özündə əks etdirir. Qələvi ilə təsir etdikdə qaz şəklində ammonyak ayrılır. Qızdırıldıqda bütün ammonium duzları parçalanır.

Ammonium karbonat
Ammonium karbonat (NH4)2CO3 — karbonat turşusunun ammonium duzudur.
== Fiziki xassələri ==
Ammonium karbonat-ağ kristalik maddədir.
Rəngsiz kristalları suda asanlıqla həll olunur.
Ammonium karbonat həm havada, həm də məhlulda qeyri-sabitdir, çünki artıq otaq temperaturunda ammonium hidrokarbonata çevrilərək ammonyak buraxır.
== Alınması ==
Müasir sintez, prosesin sadəliyini və aşağı qiymətini nəzərdə tutur. Bunu etmək üçün, NH3 qazını, CO2 qazını və su buxarını qarışdıraraq alırıq. Sürətli soyutma bu üsul üçün ilkin şərtdir.
== Kimyəvi xassələr ==
Zəif əsas və zəif turşudan əmələ gələn duz kimi kation və anionda hidrolizə məruz qalır:
(
N
H
4
)
2
C
O
3
+
H
2
O
⇄
N
H
4
H
C
O
3
+
N
H
3
⋅
H
2
O
{\displaystyle {\mathsf {(NH_{4})_{2}CO_{3}+H_{2}O\rightleftarrows NH_{4}HCO_{3}+NH_{3}\cdot H_{2}O}}}
Əsaslarla və duzlarla reaksiyaya daxil olur:
(
N
H
4
)
2
C
O
3
+
C
a
S
O
4
→
(
N
H
4
)
2
S
O
4
+
C
a
C
O
3
↓
{\displaystyle {\mathsf {(NH_{4})_{2}CO_{3}+CaSO_{4}\rightarrow (NH_{4})_{2}SO_{4}+CaCO_{3}\!\downarrow }}}
== Tətbiqi ==
Ammonium karbonat müxtəlif sahələrdə istifadə olunur:
qida sənayesində maya əvəzedicisi kimi;
ammonium sulfatın istehsalı üçün xammal kimi;
dəniz suyundan kalium çıxararkən maqnezium duzlarının çökməsi üçün;
boyaların tərkibində kosmetika istehsalında;
əczaçılıq sənayesində öskürək və ammonyak dərmanlarının istehsalında;
şərab istehsalında fermentasiya prosesini sürətləndirmək üçün;
yanğınsöndürmə üçün istifadə olunan maddələrin tərkib hissələrindən biri kimi tətbiq olunur.
== İstinadlar ==
Справочник химика / Редкол.: Никольский Б.П. и др. - 3-е изд., Л.: Химия, 1971.

Ammonium nitrat
Ammonium nitrat – NH4NO3 kimyəvi birləşmədir, nitrat turşusunun duzudur.
== Tarixi ==
İlk dəfə 1659-cu ildə İohan Qlauber tərəfindən kəşv edilmişdir.
== Fiziki xassələri ==
Ammonium nitrat ağ kristal maddədir. Suda çoxyaxşı həll olur: 100 q buzlu (oC) suda 118,3 qram, 20oC-də 192 qram, 30oC-də 241,8 qram, 50oC-də 384 qram, 80oC-də 580 qram, 100oC-də 871 qram. Həmçinin, ammonium nitrat ammonyak, piridin, metanol, etanolda həll olunur. Detonasiyanın sürəti 2570 m/s.
Normal atmosfer təzyiqində NH4NO3 kristalları üçün bir neçə modifikasiya mövcuddur. Adi şəraitlərdə rombik kristallik qəfəs stabildir. O, 32,2oC-dən yuxarı temperaturda digər rombik, parametrləri kəskin dəyişmiş formaya keçir. 82,2oC-dən yuxarı temperaturda tetraqonal, 125,8oC-dən yuxarı temperaturda kubik forma stabildir.
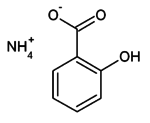
Ammonium salisilat
Ammonium salisilat – üzvi birləşmədir, rəngsiz kristal, suda həll olan, rasional formulu NH4C6H4(OH)COO olan ammonium və salisil turşusunun duzudur.
== Alınması ==
Ammonyak məhlulunun salisil turşusuna inert atmosfer mühitində təsiri ilə.
N
H
3
+
C
6
H
4
(
O
H
)
C
O
O
H
→
N
H
4
C
6
H
4
(
O
H
)
C
O
O
{\displaystyle {\mathsf {NH_{3}+C_{6}H_{4}(OH)COOH\ {\xrightarrow {}}\ NH_{4}C_{6}H_{4}(OH)COO}}}
== Fiziki xassələri ==
Ammonium salisilat suda və etanolda həll olan rəngsiz kristallar əmələ gətirir.
== Mənbə ==
Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2.

Ammonium sulfat
Ammonium sulfat — (ammonium sulfat, lat. ammonium sulphate), (NH4)2SO4 qeyri-üzvi ikili birləşmə, kükürd turşusunun ammonium duzudur. Rəngsiz şəffaf kristallardır (və ya ağ tozdur), qoxusuzdur. Ammonium sulfat, sulfat turşusunun ammonyak məhluluna təsiri və digər duzlarla mübadilə reaksiyaları ilə əldə edilir. Gübrə kimi, sulfat turşusu istehsalında, qida sənayesində, biyokimyada zülalların təmizlənməsində, suyun xlorlanmasında qatqı olaraq istifadə olunur. Ammonium sulfatın toksikliyi çox azdır.
== Fiziki xüsusiyyətləri ==
Saf ammonium sulfat - rəngsiz şəffaf kristallardır, əzilmiş formada - ağ tozdur. Hiqroskopliyi azdır.
Rombi sistem, kosmik qrup Pnma, hüceyrə parametrləri a = 0.7782 nm, b = 0.5993 nm, c = 1.0636 nm, Z = 4 kristallarını əmələ gətirir.
Sıxlığı (20 °C-də) - 1.766 q / sm3-dir.

Ammonium tiosulfat
Ammonium tiosulfat — (ammonium hiposülfit, ammonium turşusu) qeyri-üzvi birləşmə, (NH4)2SO3S düsturlu ammonium və tiosulfurik turşu duzudur, rəngsiz kristallardır, suda həll olunur. Fotoqrafiyada sürətli fiksatorların əsas komponenti kimi istifadə olunur.
== Alınması ==
Kükürd suspensiyasının ammonium hidrat məhlulu ilə yavaş reaksiyası:
4
(
N
H
3
⋅
H
2
O
)
+
4
S
→
(
N
H
4
)
2
S
O
3
S
+
2
N
H
4
H
S
+
H
2
O
{\displaystyle {\mathsf {4(NH_{3}\cdot H_{2}O)+4S\ {\xrightarrow {}}\ (NH_{4})_{2}SO_{3}S+2NH_{4}HS+H_{2}O}}}
Havada ammonium hidrosulfidin yavaş oksidləşməsi:
N
H
4
H
S
→
−
N
H
3
O
2
S
,
(
N
H
4
)
2
S
n
,
(
N
H
4
)
2
S
O
3
S
{\displaystyle {\mathsf {NH_{4}HS\ {\xrightarrow[{-NH_{3}}]{O_{2}}}\ S,(NH_{4})_{2}S_{n},(NH_{4})_{2}SO_{3}S}}}
Ammonium hidrosulfid və ammonium hidrosulfitin isti məhlullarının birləşdirilməsi:
2
N
H
4
H
S
+
4
N
H
4
H
S
O
3
→
80
o
C
3
(
N
H
4
)
2
S
O
3
S
+
3
H
2
O
{\displaystyle {\mathsf {2NH_{4}HS+4NH_{4}HSO_{3}\ {\xrightarrow {80^{o}C}}\ 3(NH_{4})_{2}SO_{3}S+3H_{2}O}}}
== Fiziki xüsusiyyətləri ==
Ammonium tiosulfat, ammonyak qoxusu olan, suda asanlıqla həll olunan, asetonda yüngül və etanolda həll olunmayan rəngsiz kristallar əmələ gətirir.
== Kimyəvi xüsusiyyətləri ==
Məhsul qarışığı meydana gətirmək üçün istilikdə parçalanır::
(
N
H
4
)
2
S
O
3
S
→
150
o
C
(
N
H
4
)
2
S
O
4
,
N
H
3
,
H
2
S
{\displaystyle {\mathsf {(NH_{4})_{2}SO_{3}S\ {\xrightarrow {150^{o}C}}\ (NH_{4})_{2}SO_{4},NH_{3},H_{2}S}}}
Seyreltilmiş məhlullarda yavaşca parçalanır::
(
N
H
4
)
2
S
O
3
S
→
τ
(
N
H
4
)
2
S
O
3
+
S
↓
{\displaystyle {\mathsf {(NH_{4})_{2}SO_{3}S\ {\xrightarrow {\tau }}\ (NH_{4})_{2}SO_{3}+S\downarrow }}}
Konsentrat turşuları ilə parçalanır:
(
N
H
4
)
2
S
O
3
S
+
2
H
C
l
→
2
N
H
4
C
l
+
S
O
2
↑
+
S
↓
+
H
2
O
{\displaystyle {\mathsf {(NH_{4})_{2}SO_{3}S+2HCl\ {\xrightarrow {}}\ 2NH_{4}Cl+SO_{2}\uparrow +S\downarrow +H_{2}O}}}
və isti seyreltilmiş turşular ilə:
(
N
H
4
)
2
S
O
3
S
+
2
H
C
l
+
H
2
O
→
100
o
C
2
N
H
4
C
l
+
H
2
S
O
4
+
H
2
S
↑
{\displaystyle {\mathsf {(NH_{4})_{2}SO_{3}S+2HCl+H_{2}O\ {\xrightarrow {100^{o}C}}\ 2NH_{4}Cl+H_{2}SO_{4}+H_{2}S\uparrow }}}
Halogenlərlə reaksiyaya girir::
(
N
H
4
)
2
S
O
3
S
+
4
C
l
2
+
5
H
2
O
→
2
N
H
4
C
l
+
2
H
2
S
O
4
+
8
H
C
l
{\displaystyle {\mathsf {(NH_{4})_{2}SO_{3}S+4Cl_{2}+5H_{2}O\ {\xrightarrow {}}\ 2NH_{4}Cl+2H_{2}SO_{4}+8HCl}}}
Natrium tiosulfat kimi, fotoşəkil materiallarını işləyərkən fiksasiya prosesinə imkan verən həll olunan komplekslər meydana gətirən gümüş halidləri ilə reaksiya verir. Natrium tiosulfatdan fərqli olaraq, bir litr məhlula 6 q gümüş konsentrasiyasına çatmağa imkan verən ammonium tiosulfat bu miqdarın demək olar ki, ikiqat artırılmasına imkan yaradır və bununla da reaktivlərin istehlakını azaldır. Fiksasiya prosesi natrium tiosulfatlı fiksatorlara nisbətən xeyli sürətlidir (bəzi emulsiyalar üçün% 50).
Bununla yanaşı, fiksatorlarda çox uzun müddət işləmək, aşağı gərginlikli yerlərdə metal gümüşün həll olunmasına,görüntü detalının itməsinə səbəb olur. Təsir xüsusilə incə dənəli emulsiyalarda və ammonium tiosulfatdakı sürətli fiksatorlarda (daha çox aktivliyi sayəsində) nəzərə çarpır ki, bu da işləmə prosesinin istilik və vaxt qaydalarına dəqiq əməl edilməsini tələb edir. Ayrıca, bu təsiri azaltmaq üçün filmlər və fotoqrafiya sənədləri üçün müxtəlif dərəcədə seyreltmədə sürətli fiksatorlar istifadə olunur; bu vəziyyətdə daha incə dənəli emulsiyaya sahib fotoqrafiya sənədləri üçün təxminən iki qat güclü seyreltmə tətbiq etmək lazımdır.
== Tətbiqi ==
Fiksasiya prosesini sürətləndirmək üçün sodium tiosulfat əvəzinə fotoqrafiyada fiksasiya həllərinin tərkib hissəsi kimi istifadə olunur.
