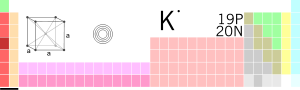

















[lat. əsli ər. əlkali] kim. Qələvi filizlər qrupundan gümüşü-ağ rəngli metal – kimyəvi element
Полностью »...цвета) II прил. 1. калиевый (относящийся к калию, содержащий в себе калий). Kalium şorası калиевая селитра, kalium zəyi калиевые квасцы 2. калийный.
Полностью »


















м kartuz (1. qabağı günlüklü furajka, papaq; 2. köhn. kağız kisə; 3. köhn. barıt kisəsi).
Полностью »...Мужской головной убор с козырьком. Парень с картузом на голове. Стянуть картуз с головы. 2) устар. Бумажный пакет, кулёк для различных сыпучих вещест
Полностью »1. пипIиш галай шапка, фуражка. 2. тупунин барут твадай бицIи чанта хьтинди. 3. чарчин чанта, чарчин кисе
Полностью »туьрк, прил. усал, гуьгъуьна амай. - И кӀвал чун фейи музейдилай кӀусни кьалмаз туш, - лагъана зи юлдашди. 3. Э. Скульптор.
Полностью »(-ди, -да, -ар) anat. qırtlaq; кӀалхандин qırtlaq -i [-ı]; * кӀалхандин ванер dilç. boğaz səsləri.
Полностью »сущ.; -ди, -да; -ар, -ра, -ри нефес къачудай ва сесер арадиз кьвезвай гьава акъатдай чка.
Полностью »n. larynx, structure in the upper throat of a human which contains the vocal chords; throat.
Полностью »арбуз : са гъиле кьве къарпуз кьаз жедач (погов.) - в одной руке двух арбузов не удержать; см. тж. хали 1.
Полностью »фарс, сущ.; -ди, -да; -ар, -ри, -ра кьен яру ширин тӀямдин кӀватӀунин форма авай чилин емиш. Чуьхвердин адет ава, Къарпуздилайни екеда
Полностью »n. watermelon, large vine-grown fruit that has a tough green rind and sweet juicy reddish flesh; melon
Полностью »n. watermelon, large vine-grown fruit that has a tough green rind and sweet juicy reddish flesh; melon
Полностью »(-ди, -да, -ар) dial. 1. qarğıdalı; 2. какруздин qarğıdalı -u [-ü]; какруздин гъуьр qarğıdalı unu; какруздин калар qarğıdalı qovurğası
Полностью »...дамах тир. Муькуьдандай Давудан чин - гьакъикъат, Пак Ватандиз къалхан хьайи къучагъ тир. М. Агьмедов. Зи дуьнья. Турни я чӀал, къалханни, Къурху г
Полностью »нар. къалин яз. Синонимар: къалинвилелди, къалиндаказ, къалиндиз. Антонимар: кьеридаказ, кьериз..
Полностью »...сельскохозяйственного производства) Организовать колхоз. Вступить в колхоз. Выйти из колхоза. 2) разг. Коллектив лиц, состоящих в коллективном хозяйс
Полностью »урус, сущ.; -ди, -да; -ар, -ри, -ра коллективламишнавай майишат. Амма бязи къалп колхозчийри колхоздин доход агъуз ийиз чпин нефсинихъ ялзава
Полностью »ə. 1) nəzərə çarpmış, görünmüş, gözə dəymiş; 2) təsəvvürə gətirilmiş, təsəvvürdə canlanmış
Полностью »...тир. # ~ гафар, ~ амалар, ~ инсанар. Астагъфируллагь! Субгьаналлагь! Калхуз хьана, гила динсуз мурдарар мискӀиндив эгечӀзава. Гь. Гь. Колхоз. Синоним
Полностью »...фикирдиз атайла, лугьудай гаф. Астагъфируллагь! Субгъаналлагъ! Калхуз хьана, гила динсуз мурдарар мискӀиндив эгечӀзава. Гь. Гь. Колхоз. 2) гуьзлеми
Полностью »...тавуртӀа, Кар аватда кӀевез, лежбер, С. С. Лежбер. Агъа СтӀалрин "калхуз Фагьума, килиг, кесибар. Алахъна кар вилик тухуз Цазава векь, ник, кесибар.
Полностью »...муртад, къарияр. Е. Э. Фитнекар къарийриз. [Эфенди] - Я мусурман стхаяр! Калхуз ийида лугьуз-лугьуз и мертад камунистри хуьре вуч къундармиш авунав
Полностью »...рекьяй ихтилат авун, хабар гун. [Мирим]. Вуч паталди жедайди я. Калхуз паталди я. А Нихет вуч я. Гьа Нихета калхуздикай доклад авуна. Гь. Гь. Колх
Полностью »...Муьжуьд сят юкъуз Крар вилик тухуз, Герек туш ялгъуз, Кесибдиз - калхуз ХупӀ ярашугъ я. С С. Квез вуч ярашугъ я. Адан дидеди дояркавализ Муьжуьд йис
Полностью »...къуват бес хьун, са кӀвалах кьилиз акъудцай къуват хьун. [Мирим] - И калхуз гьеле дувулар ахъай тавунамаз, гьа дувулдилай илисна атӀана, гадарна к
Полностью »...Къабандин хва и уьмуьрлух чарадан кӀвалерал хьайиди я. Гила и калхуз куьмекдалди кьве яц къачуна са тӀимил динж хьана лугьуз, санал акъваззавач. Гь.
Полностью »...Алахъна кар вилик тухуз Цазава векь, ник кесибари. С. С. Агъа- СтӀалрин калхуз. Векь экъечӀзава Пацан къузадиз, Гуьнеда цӀив-цӀив ийизва нуькӀре. Б.
Полностью »...Алахъна кар вилик тухуз Цазава векь, ник кесибари. С. С. Агъа- СтӀалрин калхуз. Векь экъечӀзава Пацан къузадиз, Гуьнеда цӀив-цӀив ийизва нуькӀре. Б.
Полностью »...мягьледа авай гачалабурун ЦӀаматӀ ава гьа! Камунисарин тум хьана, гьа калхуз лугьуз халкь рекьяй акъуд ийиз алахьнава. Гь. Гь. Колхоз. [ЦӀарухва].
Полностью »...магьсуларин кӀвалах Ая куь гъилик, кесибар. С. С. Агъа СтӀалрин калхуз. Айисата садахъ галаз гатфар кечирмишна. Гила, килиг жуваз, масадни гъилик ав
Полностью »