TERMODİNAMİKA
[yun. thermos və dynamikos] термодинамика (физикадин чимивал ва ам энергиядин маса жуьрейриз элкъуьнин гьалар чирдай са хел).
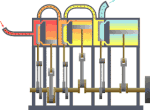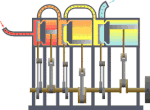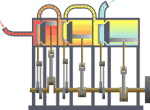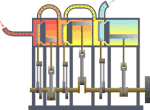







[yun. thermos və dynamikos] Fizikanın, istiliyin müvazinət qanununu və enerjinin başqa növlərinə keçməsi hallarını öyrənən bəhsi
Полностью »сущ. термодинамика (раздел физики, изучающий законы теплового равновесия и превращения теплоты в другие виды энергии)
Полностью »ру термодинамика en thermodynamics de Thermodynamik fr thermodynamique es termodinámica it termodinamica
Полностью »