












-а; м. (греч. androgunos от anēr мужчина и gunē женщина); книжн. см. тж. андрогинный, андрогинность = гермафродит
Tam oxu »













vt (bei D nach D/ kimdənsə, nə haqdasa) soruşmaq, xəbər tutmaq; parl. sual vermək
Tam oxu »vt 1. çevirmək, döndərmək; 2. (Strom, Gas) açmaq; 3. (Motor) hərəkətə gətirmək; 4. (Schrauben) sıxışdırmaq; 5
Tam oxu »is. [lat. hirsutus] tib. Yalnız qadınlarda müşahidə olunan ifrat androgen-tüklənmə xəstəliyi.
Tam oxu »I сущ. геол. аэроген II прил. аэрогенный. Aerogen süxurlar аэрогенные породы, aerogen çöküntülər аэрогенные осадки, aerogen proses аэрогенный процесс
Tam oxu »vt 1.(anspornen) təşviq etmək, ürəkləndirmək; qıcıqlandırmaq; 2. (stimulierend wirken) oyatmaq; 3. (beleben) hərəkətə gətirmək, canlandırmaq; dirçəltm
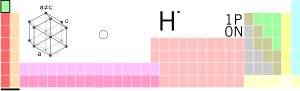
Tam oxu »...tibdə və biologiyada tətbiqi”. // Tərkibində hidrogen olan. Hidrogen birləşmələri. – Kimyəvi saf su iki kimyəvi ünsür əmələ gətirir. Bunlardan biri y
Tam oxu »...(химический элемент, легкий газ, образующий в соединении с кислородом воду). Hidrogen-peroksid перекись водорода II прил. 1. водородный (имеющий в св
Tam oxu »[yun. hydor və genos-doğma] водород (кислороддихъ галаз акахьдамаз яд арадал гъидай кьезил газ; химиядин элемент); // водороддин
Tam oxu »ру производство водорода en hydrogen generation de Wasserstofferzeugung fr génération d'hydrogène es generación de hidrógeno it generazione d'idrogeno
Tam oxu »ру газообразный водород en gaseous hydrogen de gasförmiger Wasserstoff fr hydrogène gazeux es hidrógeno gaseoso it idrogeno gassoso
Tam oxu »ру фторид водорода en hydrogen fluoride de Fluorwasserstoff fr hydrogène fluoré es hidrógeno fluorado it idrogeno fluorato
Tam oxu »прил. эндогенный: 1. возникающий, действующий внутри чего-л. тех. Endogen aşqarlar эндогенные примеси, endogen inkişaf эндогенное развитие; бот. endog
Tam oxu »Yerin fırlanması zamanı yaranan cazibə qüvvəsi və onun daxili enerjisi ilə əlaqədar olan və yerin daxilində gedən, geoloji proseslər
Tam oxu »proqnoz hesablamaları prosesində modelin həlli nəticəsində qiymətləri hesablanan göstəricilərdir.
Tam oxu »vulkanın və lava örtüklərinin yaranması prosesi /Çemekov,1969/ аккумуляция эндогенная endogenic accumulation, endogenic aggradation
Tam oxu »dağəmələgəlmə, vulkan fəaliyyəti, epeyrogenik qalxma /Meşeryakov,1972/. динамика эндогенная endogenetic dynamics
Tam oxu »vt 1. əsaslandırmaq, səbəb göstərmək; 2. (anregen) maraq oyatmaq, həvəsləndirmək
Tam oxu »...bomb; atom ~sı atom / atomic bomb, A-bomb; hidrogen ~sı hydrogen bomb, H-bomb; neytron ~sı neutron bomb; ~ tökmək / atmaq bax bombalamaq
Tam oxu »...münbitləşdirmək; boylu etmək; (bei Tieren) dölləndirmək; fig. əkmək; 3. (anregen, fördern) fig. ruhlandırmaq, həyəcanlandırmaq
Tam oxu »...çirklənməsinə qarşı təcili tədbirlər görülərsə Y.a.s.i.b.-nın antrpogen pozulmasının qarşısı alınmış olar.
Tam oxu »