













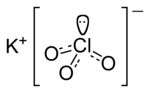





[lat.] kim. Əhəngdaşı, mərmər və s. tərkibində olan gümüşü-ağ rəngli metal – kimyəvi element
Tam oxu »...калию, содержащий в себе калий). Kalium şorası калиевая селитра, kalium zəyi калиевые квасцы 2. калийный. Kalium gübrəsi почв. калийное удобрение
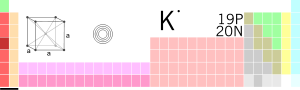
Tam oxu »[lat. əsli ər. əlkali] kim. Qələvi filizlər qrupundan gümüşü-ağ rəngli metal – kimyəvi element
Tam oxu »прил. гидрогеол. кальциевый (содержащий кальций). Kalsiumlu sular кальциевые воды, kalsiumlu torpaq кальциевая почва
Tam oxu »[lat.] kim. 1. Sink filizlərinin tərkibində olan gümüşü-ağ yüngül metal; kimyəvi element. 2. Müxtəlif çalarları olan süni sarı boya
Tam oxu »...искусственная желтая краска разных оттенков II прил. кадмиевый. Kadmium akkumulyatorları кадмиевые аккумуляторы
Tam oxu »[lat.] хим. кадмий (1. цӀарцӀар гудай лацу-гимишдин ранг алай хъуьтуьл металл; химиядин элемент; 2. гьа металлдикай авур хъипи ранг)
Tam oxu »...-ра сараривди жакьун патал сиве жедай затӀ. Малла Несреддиназ вичин кӀашкӀум вичин нерин тарцел кӀанда. Ф. Синоним: кендирагъ. [ КӀВ ] - пӀузарар кӀ
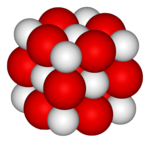
Tam oxu »-я; м. (от лат. calx (calcis) - известь) см. тж. кальциевый Химический элемент (Ca), металл серебристо-белого цвета, входящий в состав известняков, мрамора и др.
Tam oxu »-а; м. (от лат. calx (calcis) - известь) Один из самых распространённых минералов, составная часть известняка, мрамора и др.; известковый шпат.
Tam oxu »(-ди, -да; -ар) (сущ.) - жвачка; жевательная резинка : кӀашкӀум жакьун - жевать жевательную резинку.
Tam oxu »м miner. kalsit (1. mərmər, əhəng daşı və s. qatlarını əmələ gətirən çox yayılmış mineral; 2. kalsitdən ibarət olan süxurlar).
Tam oxu »сущ. геол. кальцит (минерал, природный углекислый кальций, составная часть мрамора, известняка и др.)
Tam oxu »: аллагь къалум хьурай! - клянусь богом!; рагъ къалум хьурай! - клянусь солнцем!;ваз а фу къалум хьуй! - чтоб ты подавился тем куском хлеба! (прокляти
Tam oxu »къалум хьун гл., низ, вуч жаза агакьун. Урусатдин кӀеви зулум, Са къуз адаз жеда къалум. Е. Э. 1877 - йисан бунтариз. Кайвани, тӀуб сара кьуна, зи к
Tam oxu »м etn. kalım, başlıq (keçmişdə Orta Asiya xalqlarında evlənərkən qızın ata-anasına oğlanın verdiyi pul və ya mal).
Tam oxu »is. etnoqr. Orta Asiyada: evlənərkən oğlanın qızın ata-anasına verməli olduğu pul, mal və s.; başlıq və bu adətin özü
Tam oxu »...(мягкий голубовато-серый металл, имеющий в спектре зелёные линии). Talium-sulfid сернистый таллий
Tam oxu »къалум хьун f. 1. din. qənim olmaq, cəzasını vermək, cəzalandırmaq; ваз аллагь къалум хьурай! qarğış allah sənə qənim olsun!, allah cəzanı versin!; 2.
Tam oxu »-а; м. (от тат. kalyn) 1) У некоторых народов Востока: обычай платить выкуп за невесту её родителям (первоначально - её роду); сам такой выкуп. 2) разг.-сниж. Деньги, получаемые по личной договорённос
Tam oxu »къалум хьун f. 1. din. qənim olmaq, cəzasını vermək, cəzalandırmaq; ваз аллагь къалум хьурай! qarğış allah sənə qənim olsun!, allah cəzanı versin!; 2.
Tam oxu »сущ. этногр. калым (Юкьван Азияда: мехъерзавай гадади рушан диде-бубадиз гун лазим тир пул, мал ва мс.; вегьидай пул, рехъ: гьа адет вич).
Tam oxu »м kim. anhidrit, susuz kalsium-sulfat (sement və sulfat turşusu istehsal edilən maddə).
Tam oxu »[lat.] əcz. Xlorlu kalsium və urotropin duzu (qripin qabağını almaq üçün dərman kimi işlənir).
Tam oxu »...metalloidlərlə birləşməsi. Dəmir karbidi. □ Karbid lampası – suyun kalsium karbidə təsiri nəticəsində alışan asetilenlə yanan lampa.
Tam oxu »...şorası калийная селитра, natrium şorası натриевая селитра, kalsium şorası кальциевая селитра, təbii şora природная селитра II прил. селитровый: 1. от
Tam oxu »