

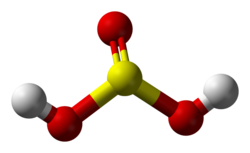




























хим. I сущ. сульфит; sulfitlər сульфиты (соли сернистой кислоты) II прил. сульфитный. Sulfit məhlulu сульфитный раствор, sulfit qatışıqları сульфитные
Полностью »






























ру сульфат натрия en sodium sulfate de Natriumsulfat fr sulfate de sodium es sulfato de sodio it solfato di sodio
Полностью »-ов; мн. (ед. - сульфит, -а; м.) (от лат. sulphur - сера); хим. см. тж. сульфитный Соли сернистой кислоты (используются в текстильной промышленности и
Полностью »хим. I сущ. сульфат; sulfatlar сульфаты (соли и эфиры серной кислоты). Təbii sulfatlar природные сульфаты II прил. 1. сульфатный. почв. Sulfat gübrələ
Полностью »хим. I сущ. сульфид; sulfidlər сульфиды (соединения серы с металлами и некоторыми неметаллами). Təbii sulfidlər природные сульфиды, üzvi sulfidlər орг
Полностью »несов. 1. söz vermək, vəd etmək, boyun olmaq; 2. irəlicədən söyləmək (xoşbəxt gələcək və s.)
Полностью »...сыну игрушку. Сулил прийти вечером. Никому не сулил много. Сулил дать денег. Сулить золотые горы (обещать невыполнимое). 2) а) что кому Подавать каки
Полностью »I сущ. хим. сульфон; sulfonlar сульфоны (сероорганические соединения) II прил. сульфоновый. Sulfon turşuları сульфоновые кислоты
Полностью »сов. 1. xüs. cütləşdirmək (heyvanları); 2. ovç. bir yerə yığmaq, bir yerə toplamaq (itləri)
Полностью »...xidmət etmək, qulluq etmək; 2. məc. işləmək; vəzifə ifa etmək; служить секретарём katib vəzifəsində işləmək; 3. məc. səbəb olmaq, bais olmaq; 4. -dir
Полностью »...спальней и кIвал адан хуьрек недай ва ксудай кIвал тир; сепаратор служит для отделения сливок от молока сепаратор некIедикай къаймах (гъери) хку
Полностью »1. xidmət etmək, qulluq etmək; 2. işləmək, vəzifə ifa etmək; 3. səbəb olmaq, bais olmaq; 4. olmaq; 5
Полностью »несов. 1. zingildəmək (it); 2. məc. inildəmək (yazıq-yazıq ağlamaq), ağlayıb sızlamaq, şikayətlənmək
Полностью »несов. 1. цIур авун, цIугъ авун (мес. гишин чIавуз кицIи). 2. пер. разг. шел-хвал авун, айхь-уйхь авун
Полностью »сов. 1. yapışdırmaq, bitişdirmək; 2. məc. dan. düzəltmək, bərpa etmək (əlaqələri və s.)
Полностью »1. кукIурун, галкIурун (ширишдалди, килинждалди). 2. галкIурна (кукIурна) расун, авун, (мес. кьвати, са затI)
Полностью »мн. сульфидар (гургуртдинни жуьреба-жуьре элементрин акахьайбрув лугьудай умуми тIвар)
Полностью »...такой формы для гигиенических целей и т.п. II прил. салфеточный. Salfet kağızı салфеточная бумага
Полностью »м soffit (1. teatr səhnəsində tavan dekorasiyası; 2. teatr səhnəsinin yuxarısında və yanlarında üfüqi halda düzülmüş lampalar sırası; 3. hər hansı bir
Полностью »...qazanıram. S.S.Axundov. [Molla Qurban:] Bəy yanında alnıaçıq, külfət yanında üzügülər olasan, inşallah!… Ə.Vəliyev. □ Külfət sahibi – ailə başçısı, a
Полностью »...близких родственников). Böyük külfət большая семья, çoxuşaqlı külfət многодетная семья, külfət başçısı глава семейства 2. эвфем. жена. Külfəti xəstəd
Полностью »...məc. (ailə qayğısı) care for family, trouble about family; Onu külfət basıb He has much trouble about (or care for) his family; He has a large family
Полностью »ж xüs. sulfidləmə (sulfit turşusu duzu ilə meyvə və tərəvəzdən konserv hazırlama).
Полностью »...litium-xlorid хлорид лития, litium-karbonat углекислый литий, litium-sulfit сернистый литий
Полностью »сущ. от глаг. sulfitləşdirmək; сульфитация (консервирование плодов, овощей и их полуфабрикатов с помощью сернистой кислоты, сернистого ангидрида)
Полностью »сущ. от глаг. sulfitləşdirilmək; сульфитация. Meyvələrin sulfitləşdirilməsi сульфитация фруктов (плодов)
Полностью »прил. сульфитированный. Sulfitləşdirilmiş meyvələr сульфитированные фрукты, sulfitləşdirilmiş şirələr сульфитированные соки
Полностью »