KARBON
[lat.] хим. карбон, углерод (химиядин элемент); // углероддин (мес. газ).
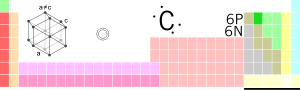
























[lat.] Təbiətdə bütün üzvi maddələrin ən mühüm tərkib hissəsi olan kimyəvi element. Radioaktiv karbon
Полностью »I сущ. хим. углерод (химический элемент, важнейшая составная часть всех органических веществ). Radioaktiv karbon радиоактивный углерод II прил
Полностью »I. i. kim. carbon II. s. carbon, carbonic; ~ qazı carbon dioxide gas, carbonic acid gas; ~ turşusu carbonic acid
Полностью »