




















[yun.] bot. Bitkilərdə: yarpaqlarda və zoğlarda yaşıl rəngin çatışmazlığından törəyən xəstəlik hal
Tam oxu »сущ. бот. хлороз: 1. болезнь растений, при которой нарушается образование хлорофилла в листьях, появляется желтизна 2. мед. форма малокровия, характер
Tam oxu »[yun.] бот. хлороз (набататрин пешерик ва кьенерик къацу ранг тахьун; набататрин азар).
Tam oxu »м мн. нет xloroz (1. tib. qanazlığı xəstəliyi; 2. bot. bitkinin yarpaqlarında və zoğlarında yaşıl rəngin olmaması; bitki xəstəliyi).
Tam oxu »
























прил. 1. хлористый (находящийся в соединении с хлором, содержащий хлор) 2. хлорный (содержащий хлор). Xlorlu əhəng хлорная известь, xlorlu su хлорная
Tam oxu »s. kim. chlorous, chloric, chlorinated; ~ əhəng chloride of lime, bleaching powder; ~ turşu chlorous acid
Tam oxu »сущ. хим., геол. хлорит; xloritlər хлориты: 1. группа слюдоподобных минералов зеленоватого цвета, входящих в состав многих горных пород 2
Tam oxu »...элементами) II прил. хлористый. Mis 1-xlorid хлористая медь (I), civə 1-xlorid хлористая ртуть (I), qızıl 1-xlorid хлористое золото (I), qalay 2-xlor
Tam oxu »сущ. хим. хлорал (бесцветная маслянистая жидкость с резким запахом, получаемая хлорированием спирта, наркотическое и болеутоляющее средство)
Tam oxu »прил. kim. 1. xlor -i[-ı]; хлорная кислота xlor turşusu; 2. xlorlu; хлорная известь xlorlu əhəng.
Tam oxu »...M.Rzaquluzadə. 2. məc. dan. Dalaşqan, davakar, savaşqan adam haqqında. □ Xoruz kimi – 1) sifəti qıpqırmızı, sağlam adam haqqında. Xoruz kimidir; 2) d
Tam oxu »...задиристом, запальчивом человеке, забияке II прил. петушиный. Xoruz lələyi петушиное перо, xoruz döyüşü петушиный бой ◊ xoruz buraxmaq пустить петуха
Tam oxu »I. i. cock; amer. rooster; hind ~u turkey-cock; II. s. cock, cockish; ~ döyüşü cockfight, cockfighting; ~ banı cock-crow; ~ pipiyi 1) cockscomb; 2) d
Tam oxu »...banına kimi (qədər) кӀекери эвердалди, экуь жедалди, экуьналди; xoruz səsi eşitməmiş (eşitməyən) кӀекрез (кӀекрен) ван тахьай, садазни ван тахьай (те
Tam oxu »I (Kürdəmir) qozun bütöv ləpəsi II (Göyçay) nar çiçəyi III (Kürdəmir) qapı cəftəsinin bərkidildiyi yer
Tam oxu »XORUZ (toyuğun erkəyi, toyuq cinsindən bəzi quşların erkəyi) Bir gün səhər dan yeri ağaranda xoruz ağac başında ucadan banladı (A.Şaiq); PƏRİDAR (arx.
Tam oxu »...Tədqiqatçılar аркать (арать) kəlməsini türk mənşəli hesab edirlər. Avdan (xoruz) sözünün av hissəsi, güman ki, ar olub. Sözün mənası “dan üzü qışq
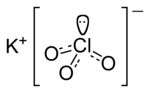
Tam oxu »is. [yun. chloros – yaşımtıl-sarı] Texnikada, sanitariyada – zərərsizləşdirici, hərbi işlərdə isə zəhərləyici maddə kimi işlədilən yaşımtıl-sarı rəngl
Tam oxu »...используется как отравляющее и обеззараживающее средство). хим. Təbii xlor природный хлор, süni xlor искусственный хлор, xlordan zəhərlənmə отравлени
Tam oxu »-а; м. Поражение зубной эмали, вызываемое фтором при его избыточном содержании в питьевой воде.
Tam oxu »м şaxta, don, bərk soyuq; ◊ мороз по коже дерёт (пробегает) dan. canıma vicə düşüb (soyuqdan).
Tam oxu »...морозный 1) а) Холод, стужа. Сильный, трескучий мороз. Ударил мороз. Пришла зима с морозами. * Мороз невелик, а стоять не велит (погов.). б) отт. Тем
Tam oxu »ру метилхлорид en methyl chloride de Methylchlorid fr chlorure de méthyle es cloruro de metilo it cloruro di metile
Tam oxu »