is. kim. potasse f, carbonate f de potassium

Karbonat
Karbonatlar — minerallar, H2CO3 turşusunun duzları. Bir neçə növə bölünür: bikarbonatlar (turş duzlar, susuz və sulu normal K.) Karbonatlar; əlavə anionlu (OH)-1, F-1, və ya Cl- Karbonatlar; (SO4)-2 və ya (PO4)-3 anionlu mürəkkəb K. İkivalentli kationlu (Ca, Mg, Fe, Mn, Ba, Sr, Pb, Zn, Cu və b.) Karbonatlar daha geniş yayılmışdır. Na+ və K+, həmçinin (NH4)+ kationu yalnız bikarbonatlar əmələ gətirə və ya ikiqat duzların tərkibinə daxil ola bilər. Nadir hallarda kationların sırasına Ni+3, Al+3, Bi+3 daxil olur. Bunlardan başqa, U+4, Ce+3, La+3 və b. ilə də Karbonatlar sırası məlumdur. Karbonatlar üçün çoxsaylı tam və ya natamam izomorf sıralar səciyyəvidir. İkiqat duzlar geniş yayılmışdır. Karbonatlar əksəriyyəti triqonal və rombik sinqoniyada, çox az bir hissəsi heksaqonal, monoklinik və b. sinqoniyalarda kristallaşır.
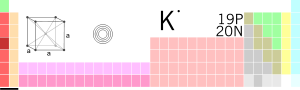
Kalium
Kalium (K) – D.İ. Mendeleyevin elementlərin dövri sistemində 19-cu element.
Kalium (K) – toхumalardakı suyun miqdarını nizama salır və ürəyin işini yaхşılaşdırır. Toхumalarda kaliumun mübadiləsi son dərəcə sürətlə gedir. Bitki
mənşəli məhsulların külündə kaliumun miqdarı bəzən 50%-dən çoх olur. Ərzaq məhsullarında kaliumun miqdarı mq%-lə belədir: çovdar çörəyi – 227; buğda
çörəyi – 208; lobya – 1144; kartof – 429; yerkökü – 284; kələm – 247; ərik qurusu – 1780; mal əti – 338; yumurta – 140; balıq – 162; inək südü – 143; pendir – 89; alma – 248. xiyar- pomidorda—yoxdur-bəzən-2 götürülür.
Kalium çox aktiv elemen olduğuna görə metallurgiyada istifadə olunmur, lakin onun nitrat duzu (selitra) əsrlərlə barıtın hazırlanmasında istifadə olunub, kalium karbonat (potaş) sabun istehsalında, alüminium-kalium sulfat xəmir hazırlanmasında, kalium hidrosulfit çaxırlara fermentasiya prosesinin qarşısını almaq üçün əlavə edilir, kalium benzoat isə konservant kimi istifadə edilir.
Kalium bütün gübrələrin tərkibinə daxildir, bu səbəbdən onun filizinin illik hasilatı 35mln ton təşkil edir. Kalium hasilinin əsas bənbəyi silvin (kalium xlorid) mineralıdır. Kalium yuyucu vasitələrin, şüşənin, farmasevtik preparatların istehsalında istifadə olunur.

Ammonium karbonat
Ammonium karbonat (NH4)2CO3 — karbonat turşusunun ammonium duzudur.
== Fiziki xassələri ==
Ammonium karbonat-ağ kristalik maddədir.
Rəngsiz kristalları suda asanlıqla həll olunur.
Ammonium karbonat həm havada, həm də məhlulda qeyri-sabitdir, çünki artıq otaq temperaturunda ammonium hidrokarbonata çevrilərək ammonyak buraxır.
== Alınması ==
Müasir sintez, prosesin sadəliyini və aşağı qiymətini nəzərdə tutur. Bunu etmək üçün, NH3 qazını, CO2 qazını və su buxarını qarışdıraraq alırıq. Sürətli soyutma bu üsul üçün ilkin şərtdir.
== Kimyəvi xassələr ==
Zəif əsas və zəif turşudan əmələ gələn duz kimi kation və anionda hidrolizə məruz qalır:
(
N
H
4
)
2
C
O
3
+
H
2
O
⇄
N
H
4
H
C
O
3
+
N
H
3
⋅
H
2
O
{\displaystyle {\mathsf {(NH_{4})_{2}CO_{3}+H_{2}O\rightleftarrows NH_{4}HCO_{3}+NH_{3}\cdot H_{2}O}}}
Əsaslarla və duzlarla reaksiyaya daxil olur:
(
N
H
4
)
2
C
O
3
+
C
a
S
O
4
→
(
N
H
4
)
2
S
O
4
+
C
a
C
O
3
↓
{\displaystyle {\mathsf {(NH_{4})_{2}CO_{3}+CaSO_{4}\rightarrow (NH_{4})_{2}SO_{4}+CaCO_{3}\!\downarrow }}}
== Tətbiqi ==
Ammonium karbonat müxtəlif sahələrdə istifadə olunur:
qida sənayesində maya əvəzedicisi kimi;
ammonium sulfatın istehsalı üçün xammal kimi;
dəniz suyundan kalium çıxararkən maqnezium duzlarının çökməsi üçün;
boyaların tərkibində kosmetika istehsalında;
əczaçılıq sənayesində öskürək və ammonyak dərmanlarının istehsalında;
şərab istehsalında fermentasiya prosesini sürətləndirmək üçün;
yanğınsöndürmə üçün istifadə olunan maddələrin tərkib hissələrindən biri kimi tətbiq olunur.
== İstinadlar ==
Справочник химика / Редкол.: Никольский Б.П. и др. - 3-е изд., Л.: Химия, 1971.

Kalsium karbonat
Kalsium karbonat — qeyri-üzvi kimyəvi birləşmə, karbon turşusu,duz və kalsium. Kimyəvi formulu —
C
a
C
O
3
{\displaystyle {\mathsf {CaCO_{3}}}}
.
Təbiətdə çox sayda mineral şəklində olur, məsələn, kalsit, araqonit və vaterit, əhəng daşı, mərmər, təbaşirin əsas tərkib hissəsidir və quş yumurtasının qabığına daxildir.
Su və etanolda həll olunmur.
Ağ qida boyası (E170) olaraq qeydiyyata alınmışdır.
== Tətbiqi ==
Ağ qida boyası E170 kimi istifadə olunur. Təbaşir kimi,lövhələrdə yazmaq üçün istifadə olunur. Gündəlik həyatda tavanları ağartmaq, ağac gövdələrini rəngləmək, bağçılıqda torpaqları alkalaşdırmaq üçün istifadə olunur.
=== Kütləvi istehsal/istifadə etmək ===
Çirklərdən təmizlənmiş kalsium karbonat, kağız və qida sənayesində, plastik, boyalar, rezin, məişət kimyəvi maddələrin istehsalında və inşaatda bir doldurucu kimi geniş istifadə olunur.
Kağız istehsalında kalsium karbonat ağardıcı, doldurucu və eyni zamanda deoksidləşdirici kimi istifadə olunur.

Karbonat turşusu
Karbonat turşusu — kimyəvi formulu H2CO3 olan zəif ikiəsaslı turşu. Turşuların bütün xassələrinə malikdir.
Karbonat turşusu normal şəraitdə suya və karbon qazına parçalandığına görə sərbəst halda mövcud deyil:
CO2 + H2O ↔ H2CO3Karbonat turşusunun molekulundakı kimyəvi rabitə polyar kovalent rabitələrdir.
== Karbonat turşusunun törəmələri ==
Karbonat turşusunun da başqa üzvi turşular kimi müvafiq törəmələri vardır. Bu törəmələrdən karbonat turşusunun xloranhidridlərini, esterlərini və amidlərini göstərmək olar.
== Karbonat turşusunun xloranhidridləri ==
Karbonat turşusunun iki cür xloranhidridi ola bilər. Bunalrada xlorkarbonat turşusu, ikincisi karboksixlorid və fosgen adlanır.
Fosgen və ya karboksixlorid birinci dəfə Devi tərəfindən dəm qazına günəz işiğının təsiri ilə xlor birləşdirməklə alınmışdır, buna görə də fosgen (fos-yunanca) işıq adlanmışdır. İndi, fosgen üçün dəm qazı ilə xloru 2000-də kömür katalizatoru üzərindən buraxılırlar.
Fosgen zəhərli boğucu qazdır, 80C-də qaynayır, benzolda yaxşı həll olur, su ilə parçalanır, karbon qazı ilə xlorid turşusu əmələ gətirir.

Stronsium karbonat
Stronsium karbonat (SrCO4)- karbon turşusunun stronsium duzudır.
Stronsium karbonat təbiətdə stronsianit mineralı kimi mövcuddu. Selestinlə (SrSO4) birgə sənaye əhəmiyyəti var.
== Fiziki xassələri ==
Suda az həll olunan rəngsiz kristallardı (25 °C -də 100 q H2O-da 2⋅10−3 q). SrCO3-ın üç modifikasiyası var: 925 °C-ə qədər α modifikasiya, araqonit tipli rombik kristalik qəfəs; 925 °C-dən yuxarı β-modifikasiyası kalsit forması; 1416 °C-dən yuxarı temperaturda və 2 MPa təzyiqdə, kub sisteminin γ-modifikasiyası mövcuddu.
S
r
C
O
3
+
C
O
2
+
H
2
O
→
S
r
(
H
C
O
3
)
2
{\displaystyle {\mathsf {SrCO_{3}+CO_{2}+H_{2}O\rightarrow Sr(HCO_{3})_{2}}}}
S
r
C
O
3
→
S
r
O
+
C
O
2
{\displaystyle {\mathsf {SrCO_{3}\rightarrow SrO+CO_{2}}}}
== Alınması ==
1. Stronsium karbonatı stronsium sulfonatın natrium karbonatın qatı məhlulu ilə reaksiya zamanı almaq olar :
2. Stronsium hidroksid karbon dioksidlə reaksiyaya girərək stronsium karbonat və su əmələ gətirir:
== Kimyəvi xassələri ==
Stronsium karbonat 1100 - 1200 °C -dən yuxarı olan temperaturda, stronsium oksid və karbon qazının əmələ gəlməsi ilə parçalanır:
Duru xlorid, azot, sirkə turşuları ilə reaksiyaya daxil olaraq duzlar əmələ gətirir:
Stronsium karbonat hidrogen sulfid ilə 900 - 1000 °C temperaturda reaksiya daxil olur, nəticədə stronsium sulfid, su və karbon dioksid alınır:
== Tətbiqi ==
Stronsium karbonat əsasən atəşfəşanlıq üçün boya kimi istifadə olunur. Həmçinin müxtəlif məqsədlər üçün istifadə olunan stronsium birləşmələrinin istehsalı üçün xammal kimi istifadə olunur. Stronsium karbonat şüşə sənayesindədə istifadə olunur. Onu şüşəyə əlavə etdikdə radiasiyaya və rentgen şüalarına davamlı edir.
== Mənbə ==
Рабинович В.А., Хавин З.Я. Краткий химический справочник.

Kalium asetat
=== Kaliumasetat ===
Tibb təcrübəsində əksər hallarda karbon turşularının duzları tətbiq edilir. Adətən, üzvi turşuların duzları asan hidrolizə uğrayır və bir çox hallarda məhlulları qələvi reaksiyalı olur. Oksikarbon turşularının turşuluq xassəsi daha qüvvətlidir, bu xassə α-oksiturşularda özünü xüsusilə göstərir. Tibbdə oksikarbon turşularının duzları (kalsium, dəmir, mis, natrium və s.) tətbiq edilir.
Kaliumasetat — CH3COOK
Preparatı almaq üçün asetat turşusu (sirkə turşusu) və kalium-hidrokarbonat məhlularını qarışdırıb buxarlandırırlar:
CH3COOH + KHCO3 → CH3COOK + CO2 + H2O
=== Fiziki-kimyəvi xassələri ===
Kalium-asetat ağ tozdur, iysiz və ya zəif sirkə turşu iylidir, azacıq şor dadlıdır. Hiqroskopikdir, havada mayeləşir. Suda və spirtdə asan həll olur, məhlulları qələvi reaksiyalıdır.
=== Tətbiqi ===
Preparat kalium ionlarının mənbəyi kimi orqanizmdə kaliumun azlığında (hipokalemiya) 10–15%-li məhlullar şəklində daxilə qəbul olunur.

Kalium bromid
Kalium bromid – kimyəvi formulu KBr olan qeyri-üzvi birləşmə,bromid turşusunun kalium duzu.
== Fiziki xassələri ==
Kalium bromid – natrium xlorida bənzər kub tipli kristalik qəfəsi olan rəngsiz kristallardı. 298 °C -ə qədər qızdırıldıqda və 1.7 GPa təzyiqi altında, kristal qəfəs sezium xlorid kimi başqa bir kub modifikasiyasına çevrilir.
== Alınması ==
1. Sənaye ehtiyacları üçün kalium bromidi, kalium karbonatın qarışıq dəmir bromidi (II, III)
Fe3Br8 ilə reaksiyası zamanı almaq olar:
4
K
2
C
O
3
+
F
e
3
B
r
8
→
8
K
B
r
+
F
e
3
O
4
+
4
C
O
2
{\displaystyle {\mathsf {4K_{2}CO_{3}+Fe_{3}Br_{8}\rightarrow 8KBr+Fe_{3}O_{4}+4CO_{2}}}}
2. Laboratoriya şəraitində kalium bromidi kalium hidroksid, brom və ammonyakın qarşılıqlı təsirindən almaq olar:
6
K
O
H
+
3
B
r
2
+
2
N
H
3
→
6
K
B
r
+
6
H
2
O
+
N
2
↑
{\displaystyle {\mathsf {6KOH+3Br_{2}+2NH_{3}\rightarrow 6KBr+6H_{2}O+N_{2}\uparrow }}}
3. Otaq temperaturunda birbaşa sintez nəticəsində:
2
K
+
B
r
2
→
2
K
B
r
{\displaystyle {\mathsf {2K+Br_{2}\rightarrow 2KBr}}}
4. Bromla daha az aktiv halogenin (yod) əvəz edilməsi nəticəsində:
2
K
I
+
B
r
2
→
2
K
B
r
+
I
2
↓
{\displaystyle {\mathsf {2KI+Br_{2}\rightarrow 2KBr+I_{2}\downarrow }}}
5. Kalium bromatın 434 °C temperaturdan yuxarı termiki parçalanma nəticəsində:
2
K
B
r
O
3
→
>
434
o
C
2
K
B
r
+
3
O
2
{\displaystyle {\mathsf {2KBrO_{3}\ {\xrightarrow {>434^{o}C}}\ 2KBr+3O_{2}}}}
=== Termodinamik kəmiyyətlər ===
== Həllolması ==
== Kimyəvi xassələri ==
Kalium bromid tipik ion duzudur. Suda həll edildikdə, dissosiyasiyaya uğrayır amma hidroliz olunmur, çünki güclü bir qələvidən (kalium hidroksid) və güclü bir turşudan (hidrobrom turşusu) alınıb. Kristalhidratlar əmələ gətirmir. Qatı bromid turşusunda həll olunmur.
1. Daha aktiv halogenlərlə reaksiya nəticəsində brom çıxarılır:
2
K
B
r
+
C
l
2
→
2
K
C
l
+
B
r
2
↑
{\displaystyle {\mathsf {2KBr+Cl_{2}\rightarrow 2KCl+Br_{2}\uparrow }}}
2. Məhlularda adi mübadilə reaksiyaları baş verə bilər:
K
B
r
+
A
g
N
O
3
→
A
g
B
r
↓
+
K
N
O
3
{\displaystyle {\mathsf {KBr+AgNO_{3}\rightarrow AgBr\downarrow +KNO_{3}}}}
3. Reduksiyaedici xassələr göstərir:
2
K
B
r
+
3
H
2
S
O
4
→
2
K
H
S
O
4
+
B
r
2
↑
+
S
O
2
↑
+
2
H
2
O
{\displaystyle {\mathsf {2KBr+3H_{2}SO_{4}\rightarrow 2KHSO_{4}+Br_{2}\uparrow +SO_{2}\uparrow +2H_{2}O}}}
(конц.
H
2
S
O
4
{\displaystyle {\mathsf {H_{2}SO_{4}}}}
, кип.)
5
K
B
r
+
3
H
2
S
O
4
+
K
B
r
O
3
→
3
B
r
2
+
3
K
2
S
O
4
+
3
H
2
O
{\displaystyle {\mathsf {5KBr+3H_{2}SO_{4}+KBrO_{3}\rightarrow 3Br_{2}+3K_{2}SO_{4}+3H_{2}O}}}
(разб.
H
2
S
O
4
{\displaystyle {\mathsf {H_{2}SO_{4}}}}
)
2
K
B
r
+
2
H
2
S
O
4
+
M
n
O
2
→
B
r
2
+
K
2
S
O
4
+
M
n
S
O
4
+
2
H
2
O
{\displaystyle {\mathsf {2KBr+2H_{2}SO_{4}+MnO_{2}\rightarrow Br_{2}+K_{2}SO_{4}+MnSO_{4}+2H_{2}O}}}
(конц.

Kalium gübrələri
Kaliumlu gübrələr azotlu və fosforlu gübrələr kimi bitkilərin qidalanması üçün vacibdir. Ona görə də çıxarılan kalium duzlarının təxminən 90%-i kaliumlu gübrələr kimi istifadə olunur.
Kalium hüceyrənin üzvi birləşmələrinin tərkibinə daxildir.
Kalium gübrələri üçün xammal təbii kalium duzlarıdır. Torpaqda kaliumun çatışmaması məhsuldarlığı və bitkilərin əlverişsiz şəraitə davamlılığını azaldır.
Kalium gübrələri xlorid və sulfatlar olmaqla iki qrupa bölünür.
Kalium xlorid istehsalı üçün xammal silvinit mineralıdır ki, o, silvin (KCl) və qalit (NaCl) qarışığından ibarətdir, tərkibində K2O 12-15% olur.
==== Sulfat gübrələri ====
Aşağıdakı minerallara malik süxurlardan alınır; kainit (KCl.MgSO4.2H2O) şenit(K2SO4. MgSO4.6H2O), lanqbeynit (K2SO4.2MgSO4) və s.
==== Kalium xlorid (KCl) ====
Xırda kristallik, çəhrayı və ya boz rəngli tozdur.

Kalium hidrosulfat
Kalium hidrosulfat (KHSO4)- qələvi metalı kaliumun və sulfat turşusunun turş duzudır.
== Fiziki xassələri ==
Kalium hidrosulfat –rombik sinqoniyanın kristallarıdı.
Suda yaxşı, aseton və etanolda həll olunmur.
== Alınması ==
1. Sulfat turşusunun kalium hidroksidə təsiri nəticəsində:
K
O
H
+
H
2
S
O
4
→
K
H
S
O
4
+
H
2
O
{\displaystyle {\mathsf {KOH+H_{2}SO_{4}\ {\xrightarrow {\ }}\ KHSO_{4}+H_{2}O}}}
2. Kalium sulfatın sulfat turşusununa təsiri nəticəsində:
K
2
S
O
4
+
H
2
S
O
4
→
2
K
H
S
O
4
{\displaystyle {\mathsf {K_{2}SO_{4}+H_{2}SO_{4}\ {\xrightarrow {\ }}\ 2\ KHSO_{4}}}}
3. Qatı sulfat turşusu ilə susuz kalium xloridin qaynadılması nəticəsində:
K
C
l
+
H
2
S
O
4
→
K
H
S
O
4
+
H
C
l
↑
{\displaystyle {\mathsf {KCl+H_{2}SO_{4}\ \xrightarrow {\ } \ KHSO_{4}+HCl\uparrow }}}
== Kimyəvi xassələri ==
1. Kalium hidrosulfatın sulu məhlulları, anionun dissosiyasiyası səbəbindən turşu reaksiyasına malikdir:
H
S
O
4
−
⇄
S
O
4
2
−
+
H
+
{\displaystyle {\mathsf {HSO_{4}^{-}\ \rightleftarrows \ SO_{4}^{2-}+H^{+}}}}
2. Kalium hidrosulfat qızdırıldıqda parçalanır:
2
K
H
S
O
4
→
240
o
C
K
2
S
O
4
+
H
2
S
O
4
{\displaystyle {\mathsf {2\ KHSO_{4}\ {\xrightarrow {240^{o}C}}\ K_{2}SO_{4}+H_{2}SO_{4}}}}
2
K
H
S
O
4
→
320
o
C
K
2
S
2
O
7
+
H
2
O
{\displaystyle {\mathsf {2\ KHSO_{4}\ {\xrightarrow {320^{o}C}}\ K_{2}S_{2}O_{7}+H_{2}O}}}
3. Qələvilərlə reaksiya zamanı orta duzlar alınır:
K
H
S
O
4
+
K
O
H
→
K
2
S
O
4
+
H
2
O
{\displaystyle {\mathsf {KHSO_{4}+KOH\ {\xrightarrow {\ }}\ K_{2}SO_{4}+H_{2}O}}}
4. Əridildikdə bəzi duzlarla reaksiya daxil olur:
K
H
S
O
4
+
K
C
l
→
500
o
C
K
2
S
O
4
+
H
C
l
{\displaystyle {\mathsf {KHSO_{4}+KCl\ {\xrightarrow {500^{o}C}}\ K_{2}SO_{4}+HCl}}}
2
K
H
S
O
4
+
T
i
O
2
→
300
o
C
T
i
O
S
O
4
+
K
2
S
O
4
+
H
2
O
{\displaystyle {\mathsf {2\ KHSO_{4}+TiO_{2}\ {\xrightarrow {300^{o}C}}\ TiOSO_{4}+K_{2}SO_{4}+H_{2}O}}}
== Tətbiqi ==
Kalium hidrosulfat boya istehsalında sulfolaşdırıcı maddə kimi istifadə olunur.
Analitik kimyada, müəyyən birləşmələrin asanlıqla həll olunan formalara çevrilməsi üçün tətbiq olunur. Qida sənayesində bioloji qatqı (Е515 ) kimi istifadə olunur.
== Mənbə ==
Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2.

Kalium nitrat
Kalium nitrat (KNO3) - qeyri -üzvi bir birləşmədir, nitrat turşusunun kalium duzudur.
== Təbiətdə tapılması ==
Təbiətdə nitrokalit mineralı kimi tanınır. Təbii kalium nitrat azot tərkibli maddələrin parçalanması nəticəsində tapılır. Bitkilərdə və heyvanlarda çox az miqdarda olur.
== Fiziki xassələri ==
Suda yaxşı həll olunur, orta dərəcədə qliserində, maye ammonyakda, hidrazində, təmiz etanolda və efirdə həll olunmur.
== Alınması ==
Gübrənin çürüməsi nəticəsində azot əmələ gəlir və saman qatlarında toplanaraq nitrifikasiyaya məruz qalır və əvvəlcə azotlu, sonra isə nitrat turşusuna çevrilir. Nitrat turşusu əhəngdaşı ilə qarşılıqlı təsir göstərərək, su ilə yuyulmuş Ca(NO3)2 alınırdı. Odun külünün əlavə edilməsi CaCO3 çökdürdü və kalium nitrat məhlulu əmələ gətirdi. Çox zaman əhəng daşı əvəzinə yığına dərhal kül əlavə edilir və kalium nitrat alınır.
C
a
(
N
O
3
)
2
+
K
2
C
O
3
⟶
2
K
N
O
3
+
C
a
C
O
3
↓
{\displaystyle {\mathsf {Ca(NO_{3})_{2}+K_{2}CO_{3}\longrightarrow 2\ KNO_{3}+CaCO_{3}\downarrow }}}
1854-cü ildə alman kimyaçısı K. Nöllner daha əlverişli və daha ucuz kalium xlorid və natrium nitratın reaksiyasına əsaslananaraq kalium nitrat istehsal etdi:
K
C
l
+
N
a
N
O
3
⟶
K
N
O
3
+
N
a
C
l
{\displaystyle {\mathsf {KCl+NaNO_{3}\longrightarrow KNO_{3}+NaCl}}}
Kalium nitratın alınmasının bir neçə başqa yoluda var.

Kalium permanganat
Kalium permanqanat (lat. Kalii permanganas - kalium permanganat, manqan turşusunun kalium duzu. Kimyəvi formulası —
KMnO
4
{\displaystyle {\ce {KMnO4}}}
.Tünd bənövşəyi, demək olar ki, qara kristallardır,suda həll edildikdə, fuşya rənginin parlaq rəngli bir həllini meydana gətirir.
== Fiziki xassələri ==
Görünüş: parlaq metal görünüşlü tünd bənövşəyi kristallar.
Odadavamlı indeks 1.59 (20 °C-də) təşkil edir.
Suda (cədvələ bax), maye ammiak, aseton (2: 100), metanol, piridində həll olunur.
=== Termodinamik xüsusiyyətləri ===
== Kimyəvi xassələri ==
Güclü oksidləşdirici maddədir.Məhlulun pH səviyyəsindən asılı olaraq müxtəlif dərəcədə oksidləşməyə malik olan manqan birləşmələrinə qədər azalaraq müxtəlif maddələri oksidləşdirir. Bir turşu mühitdə - manqan (II) birləşmələrinə,neytralda - manqan (IV)birləşmələrinə, güclü qələvidə - manqan (VI) birləşmələri ilə reaksiyaya girir.
Reaksiya nümunələri aşağıda verilmişdir (kalium sulfit ilə qarşılıqlı təsir nümunəsində):
turşulu mühitdə:
2
KMnO
4
+
5
K
2
SO
3
+
3
H
2
SO
4
⟶
6
K
2
SO
4
+
2
MnSO
4
+
3
H
2
O
{\displaystyle {\ce {2KMnO4 + 5K2SO3 + 3H2SO4 -> 6K2SO4 + 2MnSO4 + 3H2O}}}
;neytral mühitdə:
2
KMnO
4
+
3
K
2
SO
3
+
H
2
O
⟶
3
K
2
SO
4
+
2
MnO
2
+
2
KOH
{\displaystyle {\ce {2KMnO4 + 3K2SO3 + H2O -> 3K2SO4 + 2MnO2 + 2KOH}}}
;qələvi mühitdə:
2
KMnO
4
+
K
2
SO
3
+
2
KOH
⟶
K
2
SO
4
+
2
K
2
MnO
4
+
H
2
O
{\displaystyle {\ce {2KMnO4 + K2SO3 + 2KOH -> K2SO4 + 2K2MnO4 + H2O}}}
.Ancaq qeyd etmək lazımdır ki, son reaksiya (qələvi mühitdə) göstərilən sxemə əsasən yalnız azaldıcı maddənin olmaması və yüksək qələvi konsentrasiyası ilə baş verir,kalium permanganatının hidrolizində gecikməni təmin edir.
Konsentrasiya edilmiş kükürd turşusu ilə təmasda olan kalium permanganat partlayır, lakin soyuq turşu ilə səliqəli birləşdikdə, qeyri-sabit manqan oksidinin meydana gəlməsi ilə reaksiya verir (VII):
2
KMnO
4
+
H
2
SO
4
⟶
K
2
SO
4
+
Mn
2
O
7
+
H
2
O
{\displaystyle {\ce {2KMnO4 + H2SO4 -> K2SO4 + Mn2O7 + H2O}}}
.Eyni zamanda bir ara məhsul olaraq maraqlı bir birləşmə - manqan oxosulfat
MnO
3
HSO
4
{\displaystyle {\ce {MnO3HSO4}}}
meydana gələ bilər.

Kalium permanqanat
Kalium permanqanat (lat. Kalii permanganas - kalium permanganat, manqan turşusunun kalium duzu. Kimyəvi formulası —
KMnO
4
{\displaystyle {\ce {KMnO4}}}
.Tünd bənövşəyi, demək olar ki, qara kristallardır,suda həll edildikdə, fuşya rənginin parlaq rəngli bir həllini meydana gətirir.
== Fiziki xassələri ==
Görünüş: parlaq metal görünüşlü tünd bənövşəyi kristallar.
Odadavamlı indeks 1.59 (20 °C-də) təşkil edir.
Suda (cədvələ bax), maye ammiak, aseton (2: 100), metanol, piridində həll olunur.
=== Termodinamik xüsusiyyətləri ===
== Kimyəvi xassələri ==
Güclü oksidləşdirici maddədir.Məhlulun pH səviyyəsindən asılı olaraq müxtəlif dərəcədə oksidləşməyə malik olan manqan birləşmələrinə qədər azalaraq müxtəlif maddələri oksidləşdirir. Bir turşu mühitdə - manqan (II) birləşmələrinə,neytralda - manqan (IV)birləşmələrinə, güclü qələvidə - manqan (VI) birləşmələri ilə reaksiyaya girir.
Reaksiya nümunələri aşağıda verilmişdir (kalium sulfit ilə qarşılıqlı təsir nümunəsində):
turşulu mühitdə:
2
KMnO
4
+
5
K
2
SO
3
+
3
H
2
SO
4
⟶
6
K
2
SO
4
+
2
MnSO
4
+
3
H
2
O
{\displaystyle {\ce {2KMnO4 + 5K2SO3 + 3H2SO4 -> 6K2SO4 + 2MnSO4 + 3H2O}}}
;neytral mühitdə:
2
KMnO
4
+
3
K
2
SO
3
+
H
2
O
⟶
3
K
2
SO
4
+
2
MnO
2
+
2
KOH
{\displaystyle {\ce {2KMnO4 + 3K2SO3 + H2O -> 3K2SO4 + 2MnO2 + 2KOH}}}
;qələvi mühitdə:
2
KMnO
4
+
K
2
SO
3
+
2
KOH
⟶
K
2
SO
4
+
2
K
2
MnO
4
+
H
2
O
{\displaystyle {\ce {2KMnO4 + K2SO3 + 2KOH -> K2SO4 + 2K2MnO4 + H2O}}}
.Ancaq qeyd etmək lazımdır ki, son reaksiya (qələvi mühitdə) göstərilən sxemə əsasən yalnız azaldıcı maddənin olmaması və yüksək qələvi konsentrasiyası ilə baş verir,kalium permanganatının hidrolizində gecikməni təmin edir.
Konsentrasiya edilmiş kükürd turşusu ilə təmasda olan kalium permanganat partlayır, lakin soyuq turşu ilə səliqəli birləşdikdə, qeyri-sabit manqan oksidinin meydana gəlməsi ilə reaksiya verir (VII):
2
KMnO
4
+
H
2
SO
4
⟶
K
2
SO
4
+
Mn
2
O
7
+
H
2
O
{\displaystyle {\ce {2KMnO4 + H2SO4 -> K2SO4 + Mn2O7 + H2O}}}
.Eyni zamanda bir ara məhsul olaraq maraqlı bir birləşmə - manqan oxosulfat
MnO
3
HSO
4
{\displaystyle {\ce {MnO3HSO4}}}
meydana gələ bilər.

Kalium sionid
Kalium sionid — hidroyanik kalium duzu, kimyəvi formulası KCN. Hesab-faktura və ölçülərinə görə dənəvər şəkərə bənzəyən rəngsiz kristallar.Zəhərlidir. Suda həll olunur (25 °C-də 41,7%, 100 °C-də 55%). Etanolda az miqdarda həll edilir, karbohidrogenlərdə həll olunmur.
Kalium sionidinin hidrolizi zamanı sərbəst buraxılan hidrogen sionid, bəzi insanlar üçün acı badam qoxusu verir, bəziləri üçün qoxusuz qalır. Bu fərqin genetikaya bağlı olduğu ehtimal edilir.
== Alınması ==
Laboratoriyada kalium sionid sianid turşusunun konsentratlaşdırılmış kalium hidroksidi ilə qarşılıqlı təsiri ilə əldə edilir:
H
C
N
+
K
O
H
→
K
C
N
+
H
2
O
{\displaystyle {\rm {{HCN}+{\rm {{KOH}\rightarrow {\rm {{KCN}+{\rm {H_{2}O}}}}}}}}}
Kalium sionidi kalium amidinin kokslaşdırma kömürü ilə 500-600 dərəcə temperaturda reaksiya yolu ilə əldə edilə bilər.
K
N
H
2
+
C
→
K
C
N
+
H
2
↑
{\displaystyle {\rm {{KNH_{2}}+{\rm {{C}\rightarrow {\rm {{KCN}+{\rm {{H_{2}}\uparrow }}}}}}}}}
Kalium sionidi xloroform, ammonyak və kalium hidroksidindən də əldə etmək olar:
C
H
C
l
3
+
N
H
3
+
4
K
O
H
→
K
C
N
+
3
K
C
l
+
4
H
2
O
{\displaystyle {\rm {{CHCl_{3}}+{\rm {{NH_{3}}+{\rm {{4KOH}\rightarrow {\rm {{KCN}+{\rm {{3KCl}+{\rm {4H_{2}O}}}}}}}}}}}}}
Qırmızı qan duzuna kükürd turşusu və damcı əlavə edin, buxarları kalium hidroksidinin spirtli bir həllindən keçir. Sionid sərbəst buraxılacaq, spirtdə həll olunmayacaq və çöküntü olacaqdır. Vaxt keçdikcə həll çökmüş sioniddən sıyığa çevriləcəkdir. Sonra süzün və qələvi izlərini çıxarmaq üçün spirtlə yuyun.

Kalium tiosionat
Kalium tiosionat (kalium rodanid) – kimyəvi birləşmə, tiosian turşusunun kalium duzudur.
== Tapılması ==
Kalium tiosionat insan orqanizmində (tüpürcəkdə orta hesabla 0,01% və qanda (13 mq/l) olur.
== Fiziki xassələri ==
Kalium tiosionat iyi olmayan rəngsiz kristaldır. Hiqroskopikdı. Maddə 430 °C–də göy rəngə çevri- lir, soyudan zaman yenədən rəngsiz kristal olur.
== Kimyəvi xassələri ==
== Alınması ==
Kalium tiosionatı ammonium tiosianatın kalium hidroksidlə qarşılıqlı reaksiyası zamanı almaq olar
NH4SCN + KOH = KSCN + NH3 + H2O
== Tətbiqi ==
Kalium tiyosyanat (KCNS) toxuculuq sənayesində, üzvi sintezdə (məsələn, tiokarbamidin, süni xardal yağın), tiosianat ların və ya insektisidlərin alınmasında istifa də etmək olar.
== Toksikliyi ==
Kalium tiyosyanat (KCNS) – zəhərli maddədir. Ölümcül doza - 854 mq/kq təşkil edir.
== Mənbə ==
"Химическая энциклопедия" т.4 М.: Советская энциклопедия, 1995 стр. 586-587
Рабинович В.А., Хавин З.Я. "Краткий химический справочник" Л.: Химия, 1977 стр.
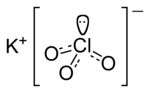
Kalium xlorat
Kalium xlorat — (Bertol duzu , kalium perklorat) — perklor turşusunun kalium duzu.
== Tarixi ==
Əvvəlcə Klod Lui Bertolle ( Bertol duzu buradan adlanır) tərəfindən 1786-cı ildə xlorun kalium hidroksidinin isti bir konsentrasiyalı məhlulu ilə keçməsi zamanı əldə edildi:
6
K
O
H
+
3
C
l
2
→
K
C
l
O
3
+
5
K
C
l
+
3
H
2
O
{\displaystyle {\mathsf {6KOH+3Cl_{2}\rightarrow KClO_{3}+5KCl+3H_{2}O}}}
== Alınması ==
Ümumiyyətlə xloratın sənaye istehsalı (və xüsusən kalium xloratı) hipokloritlərin nisbi reaksiyasına əsaslanır və bu da öz növbəsində xlorun qələvi məhlulu ilə qarşılıqlı təsiri nəticəsində əldə edilir:
C
l
2
+
2
O
H
−
→
C
l
O
−
+
C
l
−
+
H
2
O
{\displaystyle {\mathsf {Cl_{2}+2OH^{-}\rightarrow ClO^{-}+Cl^{-}+H_{2}O}}}
3
C
l
O
−
→
C
l
O
3
−
+
2
C
l
−
{\displaystyle {\mathsf {3ClO^{-}\rightarrow ClO_{3}^{-}+2Cl^{-}}}}
Prosesin texnoloji dizaynı fərqli ola bilər: ən yüksək tonnajlı məhsul kalsium hipoklorit olduğundan (ağartmanın bir hissəsidir), ən çox yayılmış proses nisbətən az həllolma qabiliyyətinə görə ana liköründən kristallaşan kalsium xlorat (istilik yolu ilə kalsium hipokloritdən əldə edilir) ilə kalium xlorid arasındakı mübadilə reaksiyasındadır.
Kalium xloratı, kalium xloridinin diafraqma olmayan elektrolizi vəziyyətində dəyişdirilmiş Bertoll üsulu ilə alınır, elektroliz zamanı əmələ gələn xlor kalium hipokloritini yaratmaq üçün kalium hidroksidi ilə yerində (təcrid olunmuş anda "yerində") qarşılıqlı təsir göstərir,bu da kalium xlorat və orijinal kalium xlorid nisbətini artırır. Qrafit anodlarından istifadə edərkən daha əlverişli bir üsul, natrium xloratın çıxarılması üçün sodium xloridin elektrolizi və kalium xloru ilə mübadilə reaksiyasıdır. Bu, anod çamurundan natrium xloratın bir həllini təmizləməyinizə imkan verir, bu, kalium xloratından qat-qat çox həllolma qabiliyyətinə malikdir və beləliklə süzülmək üçün daha əlverişlidir.
== Kimyəvi xassələri ==
~ 400 ° C temperaturda kalium perxloratın aralıq meydana gəlməsi ilə oksigen buraxılmaqla parçalanır:
4
K
C
l
O
3
→
400
o
C
3
K
C
l
O
4
+
K
C
l
{\displaystyle {\mathsf {4KClO_{3}{\xrightarrow[{}]{400^{o}C}}3KClO_{4}+KCl}}}
K
C
l
O
4
→
550
−
620
o
C
K
C
l
+
2
O
2
{\displaystyle {\mathsf {KClO_{4}{\xrightarrow[{}]{550-620^{o}C}}KCl+2O_{2}}}}
Katalizatorların iştirakı ilə (MnO2, Fe2O3, CuO və s.) parçalanma istiliyi əhəmiyyətli dərəcədə azalır (~ 200 ° C-ə qədər).
2
K
C
l
O
3
→
150
−
300
o
2
K
C
l
+
3
O
2
{\displaystyle {\mathsf {2KClO_{3}{\xrightarrow[{}]{150-300^{o}}}2KCl+3O_{2}}}}
Ammonium xloratın meydana gəlməsi ilə su-spirtli bir həllində ammonium sulfat ilə reaksiya verir:
(
N
H
4
)
2
S
O
4
+
2
K
C
l
O
3
→
2
N
H
4
C
l
O
3
+
K
2
S
O
4
{\displaystyle {\mathsf {(NH_{4})_{2}SO_{4}+2KClO_{3}\rightarrow 2NH_{4}ClO_{3}+K_{2}SO_{4}}}}
== Tətbiqi ==
Kalium xlorat katalizator iştrakı ilə qızdırıldıqda maddənin bir qismi parçalanır. Bu zaman normal şəraitə hesablanmaqla 6,72 litr qaz və 16 q bərk qalıq əmələ gəlir. Qalığa 170 q 30%-li gümüş nitrat məhlulu əlavə olunur. Son məhlulda gümüş nitratın kütlə payını hesablayın.

Kalium yodid
Kalium yodid (kalium yodid) qeyri-üzvi bir birləşmədir, kimyəvi formulu KI olan hidroiodik turşunun kalium duzudur. İşıqda sarıya çevrilən rəngsiz kristal duzdur. Yod ionlarının mənbəyi kimi geniş istifadə olunur. Natrium yodiddən daha az higroskopikdir. Tibbdə dərman, kənd təsərrüfatında gübrə olaraq, eyni zamanda fotoqrafiya və analitik kimyada da istifadə olunur.
== Fiziki xüsusiyyətləri ==
Kub sistemli rəngsiz kristallardır (a = 0,7066 нм, z = 4,
F
m
3
¯
m
{\displaystyle Fm{\bar {3}}m}
). Sıxlığı 3,115 q/sm3-dır. Bu birləşmə 681 ° C ərimə nöqtəsinə malikdir.
qaynama nöqtəsi 1324 ° C-dir. 100 q suda: 127,8 q (0 ° C), 144,5 q (20 ° C), 209 q (100 ° C)-də həll olur.

Kalium zəyi
Alüminium-kalium sulfat — kubik sinqoniya. Rast gəlmə tezliyi şkalası: çox da tez-tez rast gəlməyən.
== Xassələri ==
Rəng – ağ, rəngsiz; Mineralın cizgisinin rəngi – ağ; Parıltı – şüşə; Şəffaflıq – yarımşəffaf; Sıxlıq – 1,76; S – 2; Ayrılma – {111}üzrə qeyri-mükəmməl; Sınıqlar – qabıqvari; Başqa xassələr – dadı kəmşirindir, ağız büzüşdürücüdür, suda yaxşı həll olur (151 q/l 20°C-də); Morfologiya – kristallar: nadir rast gəlir; oktaedrik, nisbətən az – heksaedrik; Mineral aqreqatları: torpaqvari və sıx kütlələr, qabıqlar, qaysaqlar.
== Mənşəyi və yayılması ==
Arid vilayətlər üçün tipik olan ekzogen əmələgəlmə kimi göl sularının buxarlanması zamanı kristallaşır. Sulfid yataqlarının oksidləşmə zonasında da əmələ gəlir. Birlikdə rast gəldiyi minerallar: başqa sulfatlar, müxtəlif karbonatlar və s. Mineralın tapıldığı yerlər: Qara-Qum (Türkmənistan); Şorsu (Özbəkistan); Şimali Qafqaz; Dağıstan; Tambov və Ulyanovsk yaxınlığında (Rusiya); Katmay (ABŞ) və b. Azərbaycanda Böyük Qafqazın Cənub yamacının pirit saxlayan gil şistlərində yerləşən bir sıra kiçik zəy təzahürləri məlumdur. Bundan başqa bir sıra filiz yataqlarının və təzahürlərinin (Filizçay, Çıraqdərə, Gədəbəy, Bülüldüz və b.) oksidləşmə zonalarında, Kəlbəcər rayonun və Naxçıvan MR-nın bəzi yerlərində aşkar edilmişdir.
== Tətbiqi ==
Dəriaşılama işlərində, boyaq, kağız istehsalında, təbabətdə və b.

Alüminium-kalium sulfat
Alüminium-kalium sulfat — kubik sinqoniya. Rast gəlmə tezliyi şkalası: çox da tez-tez rast gəlməyən.
== Xassələri ==
Rəng – ağ, rəngsiz; Mineralın cizgisinin rəngi – ağ; Parıltı – şüşə; Şəffaflıq – yarımşəffaf; Sıxlıq – 1,76; S – 2; Ayrılma – {111}üzrə qeyri-mükəmməl; Sınıqlar – qabıqvari; Başqa xassələr – dadı kəmşirindir, ağız büzüşdürücüdür, suda yaxşı həll olur (151 q/l 20°C-də); Morfologiya – kristallar: nadir rast gəlir; oktaedrik, nisbətən az – heksaedrik; Mineral aqreqatları: torpaqvari və sıx kütlələr, qabıqlar, qaysaqlar.
== Mənşəyi və yayılması ==
Arid vilayətlər üçün tipik olan ekzogen əmələgəlmə kimi göl sularının buxarlanması zamanı kristallaşır. Sulfid yataqlarının oksidləşmə zonasında da əmələ gəlir. Birlikdə rast gəldiyi minerallar: başqa sulfatlar, müxtəlif karbonatlar və s. Mineralın tapıldığı yerlər: Qara-Qum (Türkmənistan); Şorsu (Özbəkistan); Şimali Qafqaz; Dağıstan; Tambov və Ulyanovsk yaxınlığında (Rusiya); Katmay (ABŞ) və b. Azərbaycanda Böyük Qafqazın Cənub yamacının pirit saxlayan gil şistlərində yerləşən bir sıra kiçik zəy təzahürləri məlumdur. Bundan başqa bir sıra filiz yataqlarının və təzahürlərinin (Filizçay, Çıraqdərə, Gədəbəy, Bülüldüz və b.) oksidləşmə zonalarında, Kəlbəcər rayonun və Naxçıvan MR-nın bəzi yerlərində aşkar edilmişdir.
== Tətbiqi ==
Dəriaşılama işlərində, boyaq, kağız istehsalında, təbabətdə və b.