Proses
Proses (lat. processus) — obyektin zaman çərçivəsində vəziyyətin kəmiyyət və keyfiyəət baxımından tədricən dəyişməsi; bir birinə bağlı olan hərəkətlərin cəmi, hansısa bir işin gedişi.
Termodinamik proses
Təsadüfi proses
Relyefəmələgəlmə prosesi
İnformatikada proses abstrakt anlayışdır.
Kliyent prosesi
Server prosesi
Sinxron proses
Asinxron proses
Фоновый процесс
Məhkəmə prosesi — hüquqi termin, prosessual qanunvericiliyə uyğun olaraq məhkəmədə məhkəmə işinin baxılması.
Qapalı sistemlər
Qapalı sistemdə qarşılıqlı münasibətin və ya informasiya alış verişinin olmaması və ya buna səd çıkilməsi əsasdır. Şirkətlərdəki əməliyyatlardan əyani misal çəksək, AR-GE(Tədqiqat və təkmilləşdirmə) bölümü, müəyyən ölçüdə satınalma və finans bölümlərində informasiya çıxışının önlənməsi üçün qapalı bir sistem mexanizmi mənimsənir.

Qapalı çarşı
Qapalı çarşı — İstanbul şəhərində yerləşən dünyanın ən köhnə və böyük qapalı bazarı.
Qapalı çarşıda 64 Prospekt və Küçə, 16 Xan vardır.
22 ədəd qapısı vardır.
45.000 m² bağlı sahə üzərində qurulmuşdur, 3600 dükanı vardır.
97 ədəd məmulat satılmaqdadır.
1 ədəd İnternet portalı vardır.(www.kapalicarsi.org.tr)
Sağlamlıq Mərkəzi vardır.
Polis bölməsi vardır.
Bütün Bank Şöbələri vardır.
Poçtu vardır.
Özünə aid Xüsusi Təhlükəsizlik Təşkilatı vardır.

Qapalı şəhər
Qapalı şəhər, səyahət və ya yaşayış məhdudiyyətlərinin tətbiq olunduğu, ziyarət və ya qalmaq üçün xüsusi bir icazə tələb olunduğu yaşayış məntəqəsidir.
Bu cür yaşayış məntəqələri ənənəvi hərbi bazadan daha çox yer və ya azadlıq tələb edən həssas hərbi obyektlər və ya gizli tədqiqat institutları ola bilər. Qapalı şəhərlərdə əsasən, bu müəssisələrdə işləyən işçilər yaşayırlar.
Qapalı şəhərlər ağır dərəcədə hərbiləşdirilmiş ölkələrin və ya gizli rejimlərin bir xüsusiyyətidir və hal-hazırda Sovet İttifaqının varisi olan ölkələrin bəzilərində mövcuddur. Bu gün Rusiyadakı bu cür yerlərə rəsmi olaraq “qapalı inzibati zona formasiyaları” deyilir (закрытые административно-территориальные образования zakrıtıye administrativno-territorialniye obrazovaniya və ya qısaca ЗАТО ZATO).
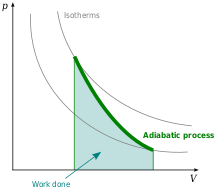
Adiabat proses
Adiabatik proses (yun. adiabatos — bağlı) — havanın vəziyyətinin (həcmi, təzyiqi, sıxlığı və temperaturunun) kənardan istilik gəlmədən dəyişilməsi.
Adiabat proses — elə termodinamik prosesə deyilir ki, burada sistem nə istilik miqdarı alır, nə də istilik miqdarı verir.
Hava yuxarı qalxdıqda onun kütləsi genişlənir və nəticədə kənara getmədən onun temperaturu hər 100m-də 1o düşür. Hava aşağı endikdə isə onun kütləsi sıxlaşır və kənardan ona istilik daxil olmadan temperaturu yenə hər 100 m-də 1o-yə qədər qalxır.

Adiabatik proses
Adiabatik proses (yun. adiabatos — bağlı) — havanın vəziyyətinin (həcmi, təzyiqi, sıxlığı və temperaturunun) kənardan istilik gəlmədən dəyişilməsi.
Adiabat proses — elə termodinamik prosesə deyilir ki, burada sistem nə istilik miqdarı alır, nə də istilik miqdarı verir.
Hava yuxarı qalxdıqda onun kütləsi genişlənir və nəticədə kənara getmədən onun temperaturu hər 100m-də 1o düşür. Hava aşağı endikdə isə onun kütləsi sıxlaşır və kənardan ona istilik daxil olmadan temperaturu yenə hər 100 m-də 1o-yə qədər qalxır.
Coğrafi proses
Coğrafi proses təbii və ya təbii-antropogen səbəblərin təsiri altında ərazinin landşaft xassələrinin tədricən, lakin bəzən kəskin dəyişməsi. Dəyişkənlik fiziki-coğrafi ola bilər və ya iqtisadi və sosial coğrafi hadisələrə toxuna bilər. Coğrafi proses təsərrüfat və cəmiyyətin həyatı üçün pozitiv və neqativ ola bilər. Ora həmişə bir sıra geosistemlərdə, iyerarxiyanın aşağı səviyyələrində baş verən dəyişikliklər daxil olur, böyük ərazilərdə inkişaf etdikdə isə bütün təbii sistemlərə təsir göstərə bilər. Coğrafi prosesin gedişində həm dağıdıcı dəyişikliklər, həm də bərpaedici suksessiyalar baş verir, belə ki, Coğrafi proses bir-birinə zidd olan qarşılıqlı təsir transformasiyası, özününizamlayıcı və özünübərpaedici təbii sistemlər kimi təzahür olunur.
Denudasion proses
Denudasiya (lat. Denudatio - "çılpaqlaşma") — Yer səthində süxurların su, külək, buz və s. ilə dağılması, yüksək sahələrdən alçaq sahələrə aparılması proseslərinin məcmusu. Yer səthi relyefinin dəyişilməsində və yeni relyef formalarının əmələ gəlməsində denudasiyanın rolu böyükdür. O, süxurları parçalayıb dağıdaraq relyefi alçaldır, hamarlayır, dağlıq sahələri denudasion düzənliklərə (peneplenlərə) çevirir. Denudasiya prosesinə aşınma, eroziya, abraziya, korroziya, deflyasiya kimi proseslər daxildir.
Denudasion proses aşınma məhsullarının daşınmasıdır. Prosesin başlıca hərəkətverici qüvvəsi ağırlıq qüvvəsidir. Bu qüvvə birbaşa və yaxud müxtəlif mütəhərrik mühitlərin vasitəsilə yaranır. Denudasion proses dar mənada müəyyən bir səthin yuyulması və qravitasion hərəkətlər vasitəsilə aşınma materiallarının daşınması kimi başa düşülür.

Kriogen proses
Kriogen proses - torpağın mənfi dərəcəyə qədər soyuması, donması və donunun açılması vaxtı baş verən fiziki, fiziki-kimyəvi və bioloji proseslərin məcmusu.
Torpağın çat verməsi
Torpaq donarkən torpaq kütləsinin qarışması və torpaq nəmliyinin miqrasiyası
Çınqıl və daş qırıntılarının torpaq kütləsindən çıxarılıb onun səthində paylanması və strukturu-oliqonal törəmələrin çoxkünclü daşlar, tor və s.-nin formalaşması
Şaxta - don qabarmaları və s.

Politrop proses
Politrop proses - xüsusi istilik miqdarı dəyişməz qalan termodinamik prosesə deyilir.
İnzibati proses
İnzibati proses — dövlət idarəetməsi sahəsində konkret inzibati işlərin həlli üzrə dövlət orqanlarının fəaliyyəti. İnzibati proses normalarına görə, məsələn, vətəndaşların şikayət və ərizələrinə baxılır, intizam tənbehi tətbiq edilir. Bu, səlahiyyətli icra hakimiyyəti orqanlarının və onların vəzifəli şəxslərinin, habelə hakimlərin inzibati prosessual hüquq normaları ilə tənzimlənən inzibati işlərin başlanması, baxılması və həlli üzrə fəaliyyəti.

İzobar proses
İzobar proses (yun. "baros" – ağırlıq, çəki) – makroskopik sistemin halının sabit təzyiqdə dəyişməsi prosesi (p = const). Qazı qızdırdıqda onun hərəkət edən porşenli silindrdə genişlənməsini izobar proses hesab etmək olar. İzobar prosesi aşağıdakı nisbətlərə bərabərdir:
Sistemə ötürülən istilik enerjisi iş görülməsinə və sistemin daxili enerjisinin (U) dəyişməsinə sərf olunur. Termodinamikanın birinci qanununa əsasən
Q
=
Δ
U
+
W
{\displaystyle Q=\Delta U+W\,}
burada W qaz tərəfindən görülən iş, U qazın daxili enerji və Q verilən istilik enerjisidir. Qapalı sistemdə təzyiq-həcm işi aşağıdakı kimi müəyyən edilir:
W
=
∫
p
d
V
{\displaystyle W=\int \!p\,dV}
burada Δ bütün proses üzrə dəyişiklik deməkdir, d isə diferensialı bildirir. Təzyiq sabit olduğundan, bu o deməkdir ki
W
=
p
Δ
V
{\displaystyle W=p\Delta V}
İdeal qaz qanununu tətbiq etməklə, alırıq ki
W
=
n
R
Δ
T
{\displaystyle W=n\,R\,\Delta T}
R qaz sabitini, n isə sabit qaldığını qəbul etdiyimiz maddənin miqdarını ifadə edir (məsələn, kimyəvi reaksiya zamanı faza keçidi yoxdur).Daxili enerjinin dəyişməsi sistemin temperaturundan asılıdır.
Δ
U
=
n
c
V
,
m
Δ
T
{\displaystyle \Delta U=n\,c_{V,m}\,\Delta T}
burada cV,m sabit həcmdə molar istilik tutumudur.
Son iki tənliyi birinci tənliylə əvəz etməklə izobar qazlar üçün verilən istiliyin təsiri altında qazın temperatur dəyişməsini təyin edə bilərik.
Q
=
n
c
V
,
m
Δ
T
+
n
R
Δ
T
Q
=
n
Δ
T
(
c
V
,
m
+
R
)
Q
=
n
Δ
T
c
P
,
m
{\displaystyle {\begin{aligned}Q&=n\,c_{V,m}\,\Delta T+n\,R\,\Delta T\\Q&=n\Delta T(c_{V,m}+R)\\Q&=n\Delta Tc_{P,m}\end{aligned}}}
burada cP sabit təzyiqdə molar istilik tutumudur.

İzotermik proses
İzotermik proses (yun. ἴσος -bərabər və θέρμη - isti) — sabit temperaturda sistemin halının dəyişməsi. Bu prosesdə temperatur sabit qalır: ΔT = 0. Havanın tədricən sıxılma prosesini və ya qabdan qazı sorub çıxaranda nasosun porşeni altında qazın genişlənməsini təxmini olaraq izotermik proses hesab etmək olar. İzotermik prosesi həyata keçirmək üçün adətən, sistemə termostat tətbiq edilir. Bu zaman prosesin dövrədəən keçirilməsi daha da tezləşir. Sistemin temperaturu isə termostatın temperaturundan fərqlənmir. İzotermik proses elə prosesdir ki, qazın çəkisi, molyar qaz və temperatur є -konstant sayılırlar.
İzotermik proses və Boyl-Mariott qanunu arasında sxematik əlaqə vardır. İzotermik proses Boyl-Mariott qanununun hesabına izah edilir.

İzoxor proses
İzoxor proses (yun. "chora" – tutum) – makroskopik sistemin halının sabit həcmdə dəyişməsi prosesi (V = const). İstənilən həcmdə və ya elektrik lampasında olan qazı qızdırdıqda onun təzyiqinin artması izoxor prosesdir.
Ədəbi proses
Ədəbi proses — ədəbiyyatın istər bir dövrdə, istərsə də, xalqın, ölkənin cəmiyyətin tarixi boyunca mövcudluğu, yaşarlığı və təkamülü. Hər bir tarixi dövrdə ədəbi proses sosial, ideoloji və estetik baxımdan müxtəlif səpkili və səviyyəli bütün ədəbi-bədii nümunələri (nəsr, şeir, dramaturgiya, ədəbi tənqid və ədəbiyyatşünaslıq) ehtiva edir. Bir çox hallarda, bədii əsərlər, müxtəlif səbəblər üzündən, yarandıqları vaxtdan, yaxud ilk nəşrindən xeyli sonra ədəbi proses nəticəsinə çevrilir (məs., Mirzə Fətəli Axundzadənin “Kəmalüddövlə məktubları” ilk dəfə 1924-cü ildə, Cəlil Məmmədquluzadənin “Danabaş kəndinin əhvalatları” povesti isə 1936-cı ildə çap edilmişdir).
Bədii ədəbiyyatın və incəsənətin növləri, həmçinin ideoloji və linqvistik hadisələrlə qarşılıqlı əlaqə və təsiri ədəbi prosesin mühüm cəhətlərindəndir. Dövrün ədəbi “özünüdərk”i (ədəbi yaradıcılıq proqram və manifestləri), həmçinin müxtəlif estetik cərəyanlar (məsələn, XX əsrin əvvəllərində Azərbaycan ədəbiyyatında “mollanəsrəddinçilər”lə “füyuzatçılar”) arasında mübarizə, qarşılıqlı beynəlmiləl ədəbi əlaqələr ədəbi prosesin ayrılmaz tərkib hissələrindəndir.
“Ədəbi proses” termini XX əsrin 20-30-cu illərində meydana gəlmiş, 60-cı illərdən geniş işlənməyə başlamışdır. Ədəbi prosesin küll halında, bütün bədii, ideya-estetik təzahürləri ilə dərindən təhlil edilib öyrənilməsi, ümumiləşdirilməsi ədəbiyyatın inkişaf meyillərini, perspektivlərini aydınlaşdırmaq baxımından müstəsna əhəmiyyətə malikdir. Azərbaycanda ədəbi prosesin sistemli şəkildə intensiv öyrənilməsinə 60-70-ci illərdən başlanılmışdır. Müasir Azərbaycan ədəbi prosesinin xüsusiyyətləri sırasına mənəvi-əxlaqi problematikaya marağın güclənməsi, insan konsepsiyasının inkişafı, tarixiliyin qüvvətlənməsi, janr-üslub sayəsində yeni axtarışlar və s. daxildir.

Yuxu (proses)
Yuxu — beynin fəaliyyət normasının minimal səviyyəyə enməsi və ətraf mühitə olan reaksiyaların azalması ilə müşayiət olunan təbii fizioloji proses. Bu proses məməlilərə, quşlara, balıqlara və bəzi başqa heyvanlara, həmçinin bəzi həşəratlara (məsələn, drozofillərə) məxsus prosesdir.
Bütün canlı varlıqlar öz güclərini bərpa etmək və həyat fəaliyyətini davam etdirmək üçün istirahətə ehtiyac duyurlar. Məcburi yuxu canlıların bütün cismi və zehni fəaliyyətlərini dayandırır.
Yuxuda anabolizm proseslərinin səviyyəsi artır, katabolizm isə enir. Normal yuxu dövri təxminən hər 24 saatdan bir olur. Bu dövr sirkad ritmi adlandırılır. Bioloji ritmin sirkad forması bir növ işıq və temperatur təsirləri ilə ontogenez dövrdə orqanizmin qazandığı, "bioloji saatlar" vasitəsi ilə həyata keçirilir.
Bu haqda alimlərin bir çox fikirləri vardır.
Bəziləri hesab edirlər ki, yuxu zamanı beyindəki qanın bir çox hissəsi bədənin müxtəlif yerlərinə axır.

Qapalı dövriyyəli televiziya
Qapalı dövriyyəli televiziya (ing. Closed-Circuit Television və ya CCTV) kameraların görüntü siqnallarını müəyyən bir yerə ötürdükləri bir sistem.
Televiziyadan ən vacib fərq siqnalın hər kəsə açıq formada ötürülməməsidir. Bir sözlə, CCTV banklar, şirkətlər və hava limanları kimi obyektlərin istifadəsi üçün nəzərdə tutulmuş bir televiziya sistemidir. Həm də müəyyən bir ərazinin görüntüsünün müəyyən monitorlara verildiyi bir ekran sistemi kimi düşünmək olar. CCTV-nin əvvəllər eksperimental istifadəsi olsa da, bu gün ümumiyyətlə təhlükəsizlik məqsədilə quraşdırılır.
CCTV sistemi CCTV kameralar, linzalar, rəqəmsal videorekorderlər və monitorlardan ibarətdir. CCTV sisteminin ən vacib xüsusiyyəti görüntülərin zamanla mütənasib şəkildə qeyd edilməsidir.
İlk ticarət məqsədli CCTV sistemi ABŞ-da 1949-cu ildə Vericon tərəfindən elan edilmişdir. İlk bağlı dövriyyəli televiziyalarının ən böyük problemi, video görüntülərin çəkilməsinin mümkün olmaması idi.

Qapalı sınıq xətt
Qapalı sınıq xətt — birinci və sonuncu təpə nöqtələri üst-üstə düşən sınıq xətt adlanır.

Yoxsulluğun qapalı dairəsi
Yoxsulluğun qapalı dairəsi — ayrı-ayrı təsərrüfat subyektlərinin, regionların və ölkələrin inkişaf etməməsini izah edən qarşılıqlı əlaqəli amillər anlayışı. İqtisadi şəraitin yaxşılaşması ilə bağlı dalğalanmalar əhalinin sonrakı artımı ilə kompensasiya edilir.
Termin ilk dəfə 1949-1950-ci illərdə Hans Sinqer və Raul Prebişin əsərlərində təklif edilmişdir.
Adambaşına düşən aşağı gəlirin minimum iqtisadi artım tempinə nail olmaq üçün lazım olan səviyyədə əmanətlərə və investisiyalara mane olduğu inkişaf etməkdə olan ölkələrdə yoxsulluğun qısır dairəsi problemdir.
Ev təsərrüfatlarının qənaət etmək qabiliyyəti və həvəsi yoxdur, aşağı gəlir aşağı tələb deməkdir, nəticədə zəif resurslar və fiziki və insan kapitalına sərmayə qoyuluşunu dayandırmaq üçün stimulların olmaması, buna görə də əmək məhsuldarlığı aşağı olaraq qalır.

Yuxu (fizioloji proses)
Yuxu — beynin fəaliyyət normasının minimal səviyyəyə enməsi və ətraf mühitə olan reaksiyaların azalması ilə müşayiət olunan təbii fizioloji proses. Bu proses məməlilərə, quşlara, balıqlara və bəzi başqa heyvanlara, həmçinin bəzi həşəratlara (məsələn, drozofillərə) məxsus prosesdir.
Bütün canlı varlıqlar öz güclərini bərpa etmək və həyat fəaliyyətini davam etdirmək üçün istirahətə ehtiyac duyurlar. Məcburi yuxu canlıların bütün cismi və zehni fəaliyyətlərini dayandırır.
Yuxuda anabolizm proseslərinin səviyyəsi artır, katabolizm isə enir. Normal yuxu dövri təxminən hər 24 saatdan bir olur. Bu dövr sirkad ritmi adlandırılır. Bioloji ritmin sirkad forması bir növ işıq və temperatur təsirləri ilə ontogenez dövrdə orqanizmin qazandığı, "bioloji saatlar" vasitəsi ilə həyata keçirilir.
Bu haqda alimlərin bir çox fikirləri vardır.
Bəziləri hesab edirlər ki, yuxu zamanı beyindəki qanın bir çox hissəsi bədənin müxtəlif yerlərinə axır.

Yuxu (fizoloji proses)
Yuxu — beynin fəaliyyət normasının minimal səviyyəyə enməsi və ətraf mühitə olan reaksiyaların azalması ilə müşayiət olunan təbii fizioloji proses. Bu proses məməlilərə, quşlara, balıqlara və bəzi başqa heyvanlara, həmçinin bəzi həşəratlara (məsələn, drozofillərə) məxsus prosesdir.
Bütün canlı varlıqlar öz güclərini bərpa etmək və həyat fəaliyyətini davam etdirmək üçün istirahətə ehtiyac duyurlar. Məcburi yuxu canlıların bütün cismi və zehni fəaliyyətlərini dayandırır.
Yuxuda anabolizm proseslərinin səviyyəsi artır, katabolizm isə enir. Normal yuxu dövri təxminən hər 24 saatdan bir olur. Bu dövr sirkad ritmi adlandırılır. Bioloji ritmin sirkad forması bir növ işıq və temperatur təsirləri ilə ontogenez dövrdə orqanizmin qazandığı, "bioloji saatlar" vasitəsi ilə həyata keçirilir.
Bu haqda alimlərin bir çox fikirləri vardır.
Bəziləri hesab edirlər ki, yuxu zamanı beyindəki qanın bir çox hissəsi bədənin müxtəlif yerlərinə axır.

Ankara Mərkəzi Qapalı Həbsxanası
Ankara Mərkəzi Qapalı Həbsxanası və Gözaltı Evi ya da Ulucanlar Həbsxanası — Ankaranın Altındağ mahalının Ulucanlar səmtində 1925–2006 arasında fəaliyyət göstərən bir həbsxanadır . Türk siyasi və ədəbi həyatında əhəmiyyətli bir yeri olan Ulucanlar Həbsxanasını bərpa edərək muzey və mədəniyyət və sənət mərkəzinə çevirmək layihəsi Altındağ Bələdiyyəsinə verildi. 2009-cu ildə başlanan bərpa işləri 2010-cu ildə tamamlandı.
Hərbi anbar kimi xidmət etmək üçün 1923-cü ildə tikilən bir binada qurulan həbsxana, 1925-ci ildə edilən təmirdən sonra həbsxana olaraq istifadə olunmağa başladı.
68 nəslin öndə gələn adlarından Deniz Gezmiş, Yusuf Aslan və Hüseyin İnan, 6 May 1972-ci ildə həbsxana həyətindəki qovaq ağacının altında edam edildi. 1980 İnqilabının ilk edamları bu həbsxanada 8 oktyabr gecəsi solçu Necdet Adalı və sağçı Mustafa Pehlivanoğlunun edamı ilə baş verdi. 13 dekabr 1980-ci ildə Erdal Erenə verilən ölüm cəzası burada icra edildi.
Həbsxanada Cüneyt Arcayürek, Mahmut Alınak, Fakir Baykurt, Hatip Dicle, Orhan Doğan, Bülent Ecevit, Yılmaz Güney, Nâzım Hikmet, Yaşar Kamal, Yavuz Öbekci, Selim Sadak, Sırrı Sakık, Kamal Tahir, Metin Toker, Muhsin Yazıcıoğlu və Leyla Zana Bir çox məşhur məhbus və məhkum qaldı.
29 sentyabr 1999-cu ildə başladılan Həyata Dönüş Əməliyyatı zamanı 10 nəfər həbsxanada öldü, 100-ə yaxın insan yaralandı.
Ulucanlar Həbsxanası 1 iyul 2006-cı ildə bağlandı.

Mərkəzi qapalı bazar (İrəvan)
Mərkəzi qapalı bazar — Ermənistanın paytaxtı İrəvandakı ticarət kompleksi. Mesrop Maştos prospektində, Göy Məsciddən bir qədər aralıda yerləşir. Bina 1952-ci ildə tikilib. Memar Qriqor Ağababyanın ən məşhur əsərlərindən biridir. 2010-cu illərin əvvəllərində yenidənqurmadan sonra ticarət kompleksinin bir hissəsi olir. İrəvanın görməli yerlərindən hesab olunur. Ermənistanın tarix və mədəniyyət abidələri siyahısına daxil edilmişdir.
Bazar 1952-ci ildə Stalin prospektində (daha sonra - Lenin prospekti, indi - Meşrop Maştots prospekti) bir ticarət meydançasının əvvəllər yerləşdiyi yerdə tikilib. Açılış 29 aprel 1952-ci il tarixində baş tutur. Layihə memar Qriqor Ağababyan tərəfindən hazırlanmış, dizayneri A. Arakelyan olmuşdur.
Xərclərin uçotunun proses metodu
Xərclərin uçotunun proses metodu (ing. process costing) — hesabat dövrü üçün istehsal olunan vahid üzrə orta maya dəyərini hesablayan məsrəflərin uçotu metodu.
İngilis professoru Kolin Druri prosesin maya dəyərinin hesablanması metodunu, hesabat dövründə məhsula (xidmətə) çəkilən ümumi məsrəflərin məhsulun (xidmətlərin) ümumi sayına bölündüyü zaman istehsal olunan hər bir vahid üçün orta xərclərin hesablanması metodueyni müddətə buraxılmışdır kimi müəyyən edir.
Metod bir çox eyni istehsal vahidləri istehsal olunduqda istifadə olunur və hər bir vahidin maya dəyərini müəyyən etməyə ehtiyac yoxdur. Bu halda məhsullar eyni istehsal olunur və birbaşa və qaimə məsrəflərinin eyni bölüşdürülməsini tələb edir. Ayrı-ayrı sifarişlər üzrə ayrıca məsrəflərin uçotu registrləri aparılmır və maya dəyəri obyekti istehsal prosesinin hər bir başa çatmış mərhələsinin məhsuluna çevrilir.
Bir sıra iqtisadçılar məsrəflərin uçotu və məhsulun maya dəyərinin hesablanması metodunu, bitməmiş istehsalat olmadan məhdud çeşiddə məhsulların istehsalına çəkilən xərclərin uçotu metodu kimi müəyyən edirlər, burada məsrəf uçotunun obyektləri istehsalda fərdi məhsulların bütün istehsal prosesinin tərkib hissəsi kimi proseslərdir.
Bir sıra iqtisadçılar istehsal vahidinin maya dəyərinin hesablanmasının üç variantını ayırd edirlər :
bir növ məhsul istehsal edilən və bitməmiş istehsalat olmayan istehsalatda (kömür, mədən sənayesi və s. müəssisələrində) məhsul vahidinin maya dəyəri istehsal prosesinin məsrəflərinin cəmini istehsal prosesinə sərf olunan məbləğə bölmək yolu ilə müəyyən edilir. məhsul vahidlərinin sayı;
bir neçə növ məhsul istehsal edilən və müstəqil istehsalın olmadığı (eyni vaxtda elektrik və istilik enerjisi istehsal edilən, yaxud neft və qaz hasil edilən və s.) sənaye sahələrində bütün növ məhsullar üçün ümumi olan məsrəflər onlar arasında müəyyən edilmiş qaydalara uyğun olaraq bölüşdürülür.
