




















(-ди, -да, -ар) kəsək; torpaq topası; къамбук къванцихъ шехьда. Ata. sözü kəsək oturub daş üçün ağlayır; къамбук хьун kəsək olmaq, kəsəyə çevrilmək, k
Tam oxu »(-ди, -да, -ар) kəsək; torpaq topası; къамбук къванцихъ шехьда. Ata. sözü kəsək oturub daş üçün ağlayır; къамбук хьун kəsək olmaq, kəsəyə çevrilmək, k
Tam oxu »(-ди, -да, -ар) çöküntü, ərp; къамбурди кьун ərp bağlamaq, ərplənmək; * къамбурда тун məc. dan. dövrələmək, mühasirəyə almaq, qomarlamaq
Tam oxu »(-ди, -да, -ар) çöküntü, ərp; къамбурди кьун ərp bağlamaq, ərplənmək; * къамбурда тун məc. dan. dövrələmək, mühasirəyə almaq, qomarlamaq
Tam oxu »-а; м. см. тж. каблучный Твёрдая набойка на подошве обуви под пяткой. Туфли на высоких каблуках. - быть под каблуком - держать под каблуком
Tam oxu »...углерода с некоторыми металлами или металлоидами. Карбид железа. Карбид кальция.
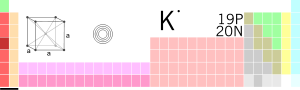
Tam oxu »[lat. əsli ər. əlkali] kim. Qələvi filizlər qrupundan gümüşü-ağ rəngli metal – kimyəvi element
Tam oxu »...Karbonun bəzi metal və metalloidlərlə birləşməsi. Dəmir karbidi. □ Karbid lampası – suyun kalsium karbidə təsiri nəticəsində alışan asetilenlə yanan
Tam oxu »...калию, содержащий в себе калий). Kalium şorası калиевая селитра, kalium zəyi калиевые квасцы 2. калийный. Kalium gübrəsi почв. калийное удобрение
Tam oxu »хим. тех. 1. сущ. карбид (соединение металла с углеродом). Metalaoxşar karbidlər металлоподобные карбиды, ikinci karbid вторичный карбид II прил. карб
Tam oxu »м daban (ayaqqabıda); ◊ быть под каблуком у кого ... ayaqaltısı olmaq; держать под каблуком tam itaətdə saxlamaq
Tam oxu »I сущ. талмуд (свод религиозных, правовых, бытовых правил и предписаний иудейства, основанный на толковании книг Ветхого завета) II прил. талмудически
Tam oxu »лал прилагательнидикай хьанвай существительнидин гзафв. кьадардин форма. Аячриз лалбурухъай кичӀеда
Tam oxu »...чувудрин диндин кьилин ктаб. Хашпарайрихъ Инжил, чувудрихъ Талмуд, мусурманрихъ Къуръан ава. ЛГ, 1992, 25. ӀV.
Tam oxu »...плохо отделанный, обработанный; простой; неизящный, топорный. Kobud ayaqqabı грубая обувь 2) перен. недостаточно тонкий, недостаточно искусный. Kobud
Tam oxu »сущ. 1. привидение (призрак человека, отсутствующего или умершего). Kabus kimi как привидение 2. призрак (что-л. созданное воображением). Müharibə kab
Tam oxu »1. грубый, неотесанный, некорректный, невежливый, неуклюжий, резкий; 2. аляповатый; 3. грубо, невежливо;
Tam oxu »bax qaba. Kobud parça. Kobud adam. Kobud hərəkət. Kobud (z.) cavab vermək. – Ağca xanım zərif əlini Qaraca qıza uzatdı, o da kobud barmaqları ilə onun
Tam oxu »is. [ər.] Qarabasma. Lakin bu, yuxu deyil, kabus idi. Ə.Əbülhəsən. // Kölgə. Küçələri, evləri taun gəzir birbəbir; Bir qara kabus kimi o hər yerə baş
Tam oxu »...kərbəlayı. Nə xortlayaydı bu şəkil ilə Molla Nəsrəddin, ey kaş; Nə kalba səbzalılarda bu xofü-vəhşət olaydı. M.Ə.Sabir.
Tam oxu »






















