
Metil
Metil — bir karbon atomuna birləşmiş üç hidrogen atomundan ibarət, metandan əldə edilən bir alkildir — CH3. Kimyəvi formullarda metil əsasən Me olaraq qısaldılır. Bu karbohidrogen qrupu bir çox üzvi birləşmələrdə mövcuddur. Molekullarda əksərən stabil bir qrupdur. Metil qrupu adətən daha böyük bir molekulun tərkib hissəsi olsa da, anion, kation və ya radikal kimi üç formada tapıla bilər. Anionda səkkiz, kationda yeddi, radikalda isə altı valent elektronu var. Hər üç formada metil çox reaktivdir və nadir hallarda müşahidə oluna bilir.
Metilium kationuna (CH3+) qaz fazasında rast gəlinir, digər fazalarda mövcud deyil. Bəzi birləşmələr metilium kationunun mənbəsi hesab olunur və üzvi kimyada praktikada geniş tətbiq olunur. Nümunə üçün, metanol protonlaşma zamanı elektrofil metil yaradan reagent verir:
CH3OH + H+ → CH3+ + H2O
Eynilə, metil yodid və metil triflata metil katalizinin ekvivalenti kimi baxılır, çünki onlar zəif nukleofillərlə SN2 reaksiyalarına dərhal məruz qalırlar.

Metil qrupu
Metil — bir karbon atomuna birləşmiş üç hidrogen atomundan ibarət, metandan əldə edilən bir alkildir — CH3. Kimyəvi formullarda metil əsasən Me olaraq qısaldılır. Bu karbohidrogen qrupu bir çox üzvi birləşmələrdə mövcuddur. Molekullarda əksərən stabil bir qrupdur. Metil qrupu adətən daha böyük bir molekulun tərkib hissəsi olsa da, anion, kation və ya radikal kimi üç formada tapıla bilər. Anionda səkkiz, kationda yeddi, radikalda isə altı valent elektronu var. Hər üç formada metil çox reaktivdir və nadir hallarda müşahidə oluna bilir.
Metilium kationuna (CH3+) qaz fazasında rast gəlinir, digər fazalarda mövcud deyil. Bəzi birləşmələr metilium kationunun mənbəsi hesab olunur və üzvi kimyada praktikada geniş tətbiq olunur. Nümunə üçün, metanol protonlaşma zamanı elektrofil metil yaradan reagent verir:
CH3OH + H+ → CH3+ + H2O
Eynilə, metil yodid və metil triflata metil katalizinin ekvivalenti kimi baxılır, çünki onlar zəif nukleofillərlə SN2 reaksiyalarına dərhal məruz qalırlar.

Metil spirti
Metanol(metil spirti, karbinol, oduncaq spirti)- CH3OH - sadə biratomlu spirt, rəngsiz zəhərli mayedir. Havayla 6,98-35,5 % qatılıqda partlayıcı qarışıq yaradır. Metanol su və üzvü birləşmələrlə istənilən nisbətdə qarışır.
Metanolu ilk dəfə 1661 ildə Boyl tərəfindən təzə mişarlanmış bərk növ oduncağın quru distilləsindən almışlar.
Metanol ilk dəfə olaraq R.Boyl tərəfindən 1661-ci ildə oduncağın quru distilləsi məhsullarında müşahidə olunmuşdur (buradan da metanolun adı yaranmışdır - ağac spirti). Təmiz halda metanol 1834-cü ildə Y.Dyuma və E. Peliqo tərəfindən ayrılmışdır və onlar metanolun kimyəvi formulunu müəyyən etmişlər.
Metanolun alınmasının bir neçə üsulu mövcuddur: qarışqa turşusunun duzlarının termiki parçalanması, metanın natamam oksidləşməsi və sintez- qazdan alınması və.s. Müasir sənayedə metanolu dəm qazı ilə hidrogen qarışığını 250 0C-də 150-200 atm. təzyiqdə CuO və ya ZnO katalizatorların iştiraki ilə alırlar. Bu zaman aşağıdakı tənlik üzrə reaksiya gedir və metil spirti alınır.

Alüminium xlorid
Alüminium xlorid – alüminium duzu və xlorid turşusu. Kimyəvi formulu — AlCl3.
Adi temperaturada 183°C-də uçur (təzyiq altında 192,6 °C-də əriyir). Suda yaxşı həll olur (25 °C temperaturda 100 qr H2O-da 44,38 qr); nəm havada hidroliz nəticəsində tüstülənməyə başlayır və HCl ayrılır. Sulu məhluldan sarımtıl-ağ rəngdə kristalohidrat — AlCl3• 6H2O formasında məhlulda asılı şəkildə üzən kristal ayrılır. Bir sıra üzvi birləşmələrdə yaxşı həll olur (məsələn, 25 °C temperaturda 100 qr etanolda 100 qr, asetonda, dixloretanda, etilenqlikolda, nitrobenzolda, karbondördxloriddə və s.).
Alüminium xloridin sənayedə alınmasının ən əhəmiyyətli üsulu — Cl2 və CO qarışığının şaxta sobalarında susuzlaşdırılmış kaolin və ya boksitə təsirinə əsaslanır:
AI2O3 + 3CO + 3Cl2 ↔ 2AICI3+3CO2 • 6H2O3
900 °C temperaturda bor üçxlorid və alüminium fosfid qarışığından bor fosfid və alüminium xlorid alınır:
BCI3 + AIP → BP + AICI3
Alüminium xloridin digər alınma üsulları da mövcuddur:
AI + FeCI3 → AICI3 + Fe
AI (OH)3 + 3HCI → AICI3 + 3H2O
CuCI2 + AI → 2AICI3 + 2Cu
AI + 6HCI → AICI3 + 3H2
Susuz alüminium xlorid bir sıra qeyri üzvi (məsələn, NH3, H2S, SO2) və üzvi (məsələn, turşuların xloranhidridləri, efirlər və s.) maddələrlə birləşmə məhsullarını əmələ gətirir. Bu da AlCl3 neft emalında və üzvi sintezlərdə (məsələn Fridel – Krafts reaksiyasında) katalizator kimi texniki tətbiqinin mühüm əhəmiyyət kəsb etdiyini gəstərir. Heksahidrat və onun məhlulları qrunt sularının təmizlənməsi, ağac emalı və digər sahələrdə istifadə olunur.
Alüminium xlorid orqanizmə daxil olduqda çox toksikdir, həm də korroziya aktivliyinə malikdir.

Barium xlorid
Barium xlorid (BaCl2) ― duzlar sinfinə aid qeyri-üzvi birləşmə. Barium xlorid rəngsiz, romb şəklində olan kristaldır.
== Alınması ==
Bariumun xlor ilə reaksiyası zamanı:
B
a
+
C
l
2
⟶
B
a
C
l
2
{\displaystyle {\mathsf {Ba+\ Cl_{2}\longrightarrow \ BaCl_{2}}}}
Barium oksidin xlorid turşusu ilə reaksiyası zamanı:
B
a
O
+
2
H
C
l
⟶
B
a
C
l
2
+
H
2
O
{\displaystyle {\mathsf {BaO+2HCl\longrightarrow \ BaCl_{2}+\ H_{2}O}}}
Barium hidroksidin xlorid turşusu ilə reaksiya zamanı:
B
a
(
O
H
)
2
+
2
H
C
l
⟶
B
a
C
l
2
+
2
H
2
O
{\displaystyle {\mathsf {Ba(OH)_{2}+2HCl\longrightarrow \ BaCl_{2}+2H_{2}O}}}
Barium sulfidin kalsium xlorid ilə reaksiya zamanı:
B
a
S
+
C
a
C
l
2
⟶
B
a
C
l
2
+
C
a
S
{\displaystyle {\mathsf {BaS+\ CaCl_{2}\longrightarrow \ BaCl_{2}+\ CaS}}}
Barium karbonatin xlorid turşusu ilə reaksiya zamanı:
B
a
C
O
3
+
2
H
C
l
⟶
B
a
C
l
2
+
H
2
O
+
C
O
2
↑
{\displaystyle {\mathsf {BaCO_{3}+2HCl\longrightarrow \ BaCl_{2}+\ H_{2}O+\ CO_{2}\uparrow }}}
== Kimyəvi xassələri ==
Barium xlorid suda yaxşı, spirtdə az miqdarda, dietil efirində tamami ilə həll olunmur. Barium xlorid duzlarla dəyişmə reaksiyalarına yalnız həll olunmayan bir maddə, qaz halında və ya bir qədər az dissosiasiya olun birləşmə alınanda daxil olur:
B
a
C
l
2
+
M
g
S
O
4
⟶
B
a
S
O
4
↓
+
M
g
C
l
2
{\displaystyle {\mathsf {BaCl_{2}+\ MgSO_{4}\longrightarrow \ BaSO_{4}\downarrow +\ MgCl_{2}}}}
B
a
C
l
2
+
K
2
C
r
O
4
⟶
B
a
C
r
O
4
↓
+
2
K
C
l
{\displaystyle {\mathsf {BaCl_{2}+\ K_{2}CrO_{4}\longrightarrow \ BaCrO_{4}\downarrow +2\ KCl}}}
Müəyyən turşular ilə reaksiyaya daxil olur:
B
a
C
l
2
+
H
2
S
O
4
⟶
B
a
S
O
4
↓
+
2
H
C
l
{\displaystyle {\mathsf {BaCl_{2}+\ H_{2}SO_{4}\longrightarrow \ BaSO_{4}\downarrow +2\ HCl}}}
== Tətbiqi ==
Barium xlorid kənd təsərrüfatında bitki zərərvericilərinin məhv edilməsi üçün istifadə olunur. Analitik kimyada məhlullarda sulfat turşusu və ya sulfatları aşkar etmək üçün (ağ çöküntü əmələ gəlir) tətbiq olunur. Keramik məhsuları hazırlamaq üçün istifadə olunan kütlənin tərkibinə daxil olur. Kimya sənayesində bariy duzları və bariy əsaslı reaktivlərin istehsalı üçün istifadə olunur.
== Toksikliyi ==
Barium xlorid – toksik maddədir. Dəri və gözlərə düşdükdə, kimyəvi yanığlara səbəb ola bilər, yanğın və partlayışa davamlıdır. Buxarıyla nəfəs aldıqda öskürək, boğazda ağrı baş verir.

Maqnezium xlorid
Maqnezium xlorid (MgCl2) – qeyri-üzvi birləşmədi, xlorid turşusunun maqnezium duzu.
Magnezium xlorid – susuz duzdur, hiqroskopik heksoqonal
Rəngsiz kristallar şəklində kristallaşır. Acı dadı var.
Susuz maqnezium xloridi maqneziumun birbaşa xlorlanması nəticəsində almaq olar:
M
g
+
C
l
2
→
M
g
C
l
2
{\displaystyle {\mathsf {Mg+Cl_{2}\rightarrow MgCl_{2}}}}
Magnezium xloridi əsası oksidlərin xlorid turşusu ilə reaksiyası zamanı almaq olar:
2
M
g
O
+
2
C
l
2
→
2
M
g
C
l
2
+
O
2
{\displaystyle {\mathsf {2MgO+2Cl_{2}\rightarrow 2MgCl_{2}+O_{2}}}}
M
g
O
+
C
+
C
l
2
→
M
g
C
l
2
+
C
O
{\displaystyle {\mathsf {MgO+C+Cl_{2}\rightarrow MgCl_{2}+CO}}}
Magnezium xlorid suda yaxşı həll olunur, piridində, spirtlərdə, asetonda zəif həll olunur.
Magnezium xlorid qələvilər və ammonyak məhlulu ilə reaksiya girir:
M
g
C
l
2
+
2
N
a
O
H
→
M
g
(
O
H
)
2
↓
+
2
N
a
C
l
{\displaystyle {\mathsf {MgCl_{2}+2NaOH\rightarrow Mg(OH)_{2}\downarrow +\,2NaCl}}}
Magnezium xloridə natrium karbonat əlavə edildikdə, əsası maqnezium karbonatın çöküntüsü əmələ gəlir:
5
M
g
C
l
2
+
5
N
a
2
C
O
3
+
2
H
2
O
→
M
g
(
O
H
)
2
⋅
3
M
g
C
O
3
↓
+
M
g
(
H
C
O
3
)
2
+
10
N
a
C
l
{\displaystyle {\mathsf {5MgCl_{2}+5Na_{2}CO_{3}+2H_{2}O\rightarrow Mg(OH)_{2}\cdot 3MgCO_{3}\downarrow +\,Mg(HCO_{3})_{2}+\,10NaCl}}}
M
g
C
l
2
+
2
N
a
H
C
O
3
→
M
g
C
O
3
↓
+
2
N
a
C
l
+
H
2
O
+
C
O
2
↑
{\displaystyle {\mathsf {MgCl_{2}+2NaHCO_{3}\rightarrow MgCO_{3}\downarrow +\,2NaCl+\,H_{2}O+CO_{2}\uparrow }}}
2
M
g
C
l
2
+
L
i
A
l
H
4
→
M
g
H
2
+
L
i
C
l
+
A
l
C
l
3
{\displaystyle {\mathsf {2MgCl_{2}+LiAlH_{4}\rightarrow MgH_{2}+\,LiCl+\,AlCl_{3}}}}
M
g
C
l
2
⋅
6
H
2
O
→
120
∘
C
M
g
C
l
2
⋅
4
H
2
O
+
2
H
2
O
{\displaystyle {\mathsf {MgCl_{2}\cdot 6H_{2}O\xrightarrow {120^{\circ }C} MgCl_{2}\cdot 4H_{2}O+2H_{2}O}}}
M
g
C
l
2
⋅
4
H
2
O
→
150
∘
C
M
g
C
l
2
⋅
2
H
2
O
+
2
H
2
O
{\displaystyle {\mathsf {MgCl_{2}\cdot 4H_{2}O\xrightarrow {150^{\circ }C} MgCl_{2}\cdot 2H_{2}O+2H_{2}O}}}
M
g
C
l
2
⋅
2
H
2
O
→
240
∘
C
M
g
C
l
2
⋅
H
2
O
+
H
2
O
{\displaystyle {\mathsf {MgCl_{2}\cdot 2H_{2}O\xrightarrow {240^{\circ }C} MgCl_{2}\cdot H_{2}O+H_{2}O}}}
M
g
C
l
2
⋅
H
2
O
→
>
300
∘
C
M
g
O
H
C
l
+
H
C
l
{\displaystyle {\mathsf {MgCl_{2}\cdot H_{2}O\xrightarrow {>300^{\circ }C} MgOHCl+HCl}}}
2
M
g
O
H
C
l
→
>
400
∘
C
M
g
2
O
C
l
2
+
H
2
O
{\displaystyle {\mathsf {2MgOHCl\xrightarrow {>400^{\circ }C} Mg_{2}OCl_{2}+H_{2}O}}}
Maqnezium xlorid əsasən maqnezium istehsalında istifadə olunur. Həm çinin buz və qarın əriməsi üçün tətbiq olunur. Qarla təmasda olduqda onu tez bir zamanda əridir.
Magnezium xlorid qida sənayesində çox istifadə olunur. E 511 qida qatqısı kimi qeyd olunur.
Рабинович В.А., Хавин З.Я. Краткий химический справочник.

Natrium xlorid
NaCl və ya Natrium-xlorid – Xlorid turşusunun (HCl) turşu qalığının natriumlu duzudur. NaCl dəniz suyunda boldur və ona şor dad verir. Təbiətdə qalit (qaya duzu) şəklində yaranır. NaCl saf halda rəngsiz, kristallik maddədir. Amma xarici təsirlərə məruz qaldığı zaman mavi, bənövşəyi, çəhrayı, sarı və ya boz rənglərə çala bilir.

Polivinil xlorid
Polivinil xlorid (PVX) hazırda istehsal həcminə və tətbiq sahələrinə görə geniş yayılmış sintetik polimerlər sırasına daxildir. Ondan süni dəri, örtük və kabel-izolyasiya materialları, liflər və s. istehsal olunur. PVX əsasən, vinilxloridin emulsiyada və suspenziyada perosid inisiatorları iştirakı ilə 4-12 MPa təzyiqdə və 30-700-də polimerləşdirilməsi yolu ilə alınır. Alınan polimer "baş-ayaq" birləşməyə uyğun quruluşa malik olur.
PVX narın toz halındadır. Nisbətən aşağı molekul kütləli PVX asetonda, mürəkkəb efirlərdə, xlorlaşmış karbohidrogenlərdə həll olur. Daha yüksək molekul kütləli PVX isə tsikloheksanda, dimetilformamiddə, tetrahidrofuranda, dioksanda yaxşı həll olur.
Polivinil xlorid polietilendən sonra məişətdə ən geniş istifadə olunan sintetik polimerdir. PVX-dən boru, pəncərə çərçivəsi, jalyuzlar, döşəmə üçün qablamalar, oyuncaqlar və s.

Radium-xlorid
Radium-xlorid — Qələvi torpaq metallarından radium ən axırda kəşf edilmişdir, hələ D. İ. Mendeleyev onun üçün dövri sistemdə əvvəlcədən boş xana saxlamışdı. Radium 1898-ci ildə uran filizində tapıldı. Pyer və Mariya Kürilər bu mineralı tədqiq edərkən bəzi filiz nümunələrinin radioaktivliyinin onlardakı uranın miqdarına görə gözləniləndən böyük olduğunu müəyyən etdilər. Onlar belə nəticəyə gəldilər ki, uran filizinin tərkibində radioaktivliyi uranınkından yüksək olan yeni element vardır. Tezliklə onlar bu birləşməni ayıra bildilər. Radioaktiv parçalandığına görə elementi radium adlandırdılar. Kürilər təqribən bir ton uran filizini işləyərək, 0,1 q-a yaxın radium duzu aldılar. Radium metalı isə 1910-cu ildə civə katodundan istifadə etməklə Radium-xlorid məhlulunun elektrolizindən alındı.
Radium gümüşü – ağ rəngli ağır, çətinəriyən metaldır (6,5x10–4 atm təzyiqə tər=0,63C0). Digər qələvi – torpaq metallar kimi o da sərbəst halda yüksək kimyəvi aktivliyə malikdir, su ilə şiddətli reaksiyaya daxil olaraq hidrogen ayırır: Ra+2H2O=Ra(OH)2+H2.

Tiofosforil xlorid
Tiofosforil xlorid - PSCl3 formullu qeyri-üzvi bir birləşmədir. [1] Havada buxarlanan rəngsiz, kəskin qoxulu bir mayedir. Fosfor xloriddən sintez olunur və böcək öldürücü maddələri istehsal etmək üçün istifadə olunur.
Tiofosforil xlorid fosfortrixloriddən başlayaraq bir neçə reaksiya nəticəsində yarana bilər. Bu səbəbdən sənaye istehsalında ən çox istifadə edilən və praktik sintez, fosfortrixloridin kükürdün artıq miqdarı ilə 180 ° C-də birbaşa reaksiya verməsidir. [2]
PCl3 + S → PSCl3
Bu metoddan istifadə edərək süzmə üsulu ilə təmizləndikdən sonra məhsul çox ola bilər. Katalizatorlar reaksiyanı daha aşağı temperaturda aparmağa kömək edir, lakin lazım olmur. Alternativ olaraq, fosfor pentasulfid və fosfor pentaxloridin birləşməsi yolu ilə də əldə edilir. [3]
3 PCl5 + P2S5 → 5 PSCl3
PSCl3 benzol, karbon tetraxlorid, xloroform və karbon disülfiddə həll olur. [1] Bununla birlikdə tiofosfatları istehsal etmək üçün spirt və aminlər kimi əsasi məhlullarda sürətlə hidroliz edilir.
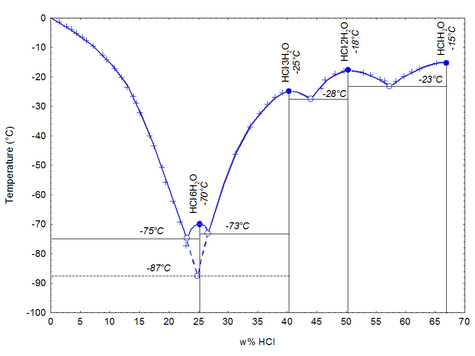
Xlorid turşusu
Xlorid turşusu (HCl) — hidrogen və xlor elementlərindən ibarət olan, otaq istiliyi və normal təzyiqdə qaz halında olan kimyəvi bir mürəkkəbdir. IX əsrdə Ərəb kimyacı Cabir min Həyyan tərəfindən kəşf edildi və sonra simə sahəsində istifadə e dildi. Sənaye İnqilabı əsnasında, sənayedəki əhəmiyyəti kəşf edilən turşu, əvvəl Leblanc əməliyyatı, sonra Solvay əməliyyatı ilə sənaye sahəsində istehsal olunmağa başladı. Xlorid turşusu, tarixdə yeni asanlıqların kəşfində əhəmiyyətli rollar oynadı. Hal-hazırda PVC'den dəmir-polada, orqanik maddə istehsalından qida sektoruna qədər az qala bütün sahələrdə xlorid turşusundan istifadə edilməkdədir.
Xlorid turşusu, təmin etdiyi asanlıqlara baxmayaraq, zəhərli bir maddədir və insan toxumaları başda olmaq üzrə çoxu səthə böyük təxribat verir. Bu səbəblə bu turşu ilə çalışılarkən təhlükəsizlik tədbirləri ən üst səviyyədə tutulmalıdır. Turşu, toksik olmasıyla bərabər, gözlər və dəri üçün tahriş edəndir, dəridə yanıqlara səbəb olmaqdadır və tənəffüs sistemi üçün tahriş edici xüsusiyyət daşımaqdadır. Hidrogen xlor, normal şərtlərdə −27.32 °C də əriyər, 110 °C də qaynar. Xlorid turşusu əldə edə bilmək üçün əvvəlcə hidrogen xlor gazınının əldə etmək lazımdır.

Kadmium xlorid
Kadmium (II) xlorid (CdCl2) — qeyri-üzvi bir birləşmədir, kadmium metalının və xlorid turşusunun duzu, rəngsizkristallar, higroskopik, suda asanlıqla həll olunur,
kristallohidratlar əmələ gətirir.
Kadmium (II) xlorid heksoqonal sistemin rəngsiz
kristallarını, fəza qrupunu R-3m, hüceyrə parametrlərini a = 0.385 nm, c = 1.746 nm, Z = 3 əmələ gətirir. Sulu məhlulları hidrolizə görə turş reaksiya yaradır. Metalik kadmium(6000C-də kadmiumun~ 15%) kadmium xloridin ərintisində həll olunur.
Metalik kadmiumun xlorid turşusunda həll edilməsi nəticəsində almaq olur:
C
d
+
2
H
C
l
→
τ
C
d
C
l
2
+
H
2
↑
{\displaystyle {\mathsf {Cd+2HCl\ {\xrightarrow {\tau }}\ CdCl_{2}+H_{2}\uparrow }}}
Kadmium oksidin xlorid turşusunda həll edilməsi:
C
d
O
+
2
H
C
l
→
C
d
C
l
2
+
H
2
O
{\displaystyle {\mathsf {CdO+2HCl\ {\xrightarrow {}}\ CdCl_{2}+H_{2}O}}}
Sadə maddələr arasındakı reaksiya nəticəsində:
C
d
+
C
l
2
→
450
−
500
o
C
C
d
C
l
2
{\displaystyle {\mathsf {Cd+Cl_{2}\ {\xrightarrow {450-500^{o}C}}\ CdCl_{2}}}}
Kadmium oksidin və xlor qazı ilə reaksiyası nəticəsində:
2
C
d
O
+
2
C
l
2
→
500
−
600
o
C
2
C
d
C
l
2
+
O
2
{\displaystyle {\mathsf {2CdO+2Cl_{2}\ {\xrightarrow {500-600^{o}C}}\ 2CdCl_{2}+O_{2}}}}
Kristallohidratların qızdırılması nəticəsində susuz duzları alınır:
C
d
C
l
2
⋅
2
,
5
H
2
O
→
120
−
170
o
C
C
d
C
l
2
+
2
,
5
H
2
O
{\displaystyle {\mathsf {CdCl_{2}\cdot 2,5H_{2}O\ {\xrightarrow {120-170^{o}C}}\ CdCl_{2}+2,5H_{2}O}}}
Hidrogen xloridlə və qələvi metal xloridlərlə kompleks yaradır:
C
d
C
l
2
+
2
H
C
l
→
H
2
[
C
d
C
l
4
]
{\displaystyle {\mathsf {CdCl_{2}+2HCl\ {\xrightarrow {}}\ H_{2}[CdCl_{4}]}}}
C
d
C
l
2
+
2
K
C
l
→
K
2
[
C
d
C
l
4
]
↓
{\displaystyle {\mathsf {CdCl_{2}+2KCl\ {\xrightarrow {}}\ K_{2}[CdCl_{4}]\downarrow }}}
Qaynar qatı sulfat turşusu ilə reaksiyaya daxil olur:
C
d
C
l
2
+
H
2
S
O
4
→
100
o
C
C
d
S
O
4
+
2
H
C
l
↑
{\displaystyle {\mathsf {CdCl_{2}+H_{2}SO_{4}\ {\xrightarrow {100^{o}C}}\ CdSO_{4}+2HCl\uparrow }}}
Qələvilərlə reksiyaya daxil olur:
C
d
C
l
2
+
2
N
a
O
H
→
C
d
(
O
H
)
2
+
2
N
a
C
l
{\displaystyle {\mathsf {CdCl_{2}+2NaOH\ {\xrightarrow {}}\ Cd(OH)_{2}+2NaCl}}}
Fotoreagentlərdə.
Qalvanik elementlərdə elektrolitin tərkib hissəsi kimi.
Üzvi sintezdə katalizator kimi.
Sənayedə günəş panellərinin istehzalı zamanı.
Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр.

Metil-etil keton
Metil-etil keton (butanon) CH3-C(O)-CH2-CH3-alifatik ketonların homoloji qrupunun ikinci üzvü olan ketonlar sinfinin kimyəvi birləşməsidir.
Metil-etil keton asetonun qoxusunu xatırladan rəngsiz uçucu mayedir. Su ilə məhdud bir halda,əksər üzvi həlledicilərlə isə istənilən nisbətdə qarışır. Su ilə azeotrop bir qarışıq əmələ gətirir.
Sənayedə metil etil keton alınmasının bir neçə metodu var onlardan biridə n-butanın maye fazalı sərbəst radikalın oksidləşməsi zamanı baş verir.
Reaksiya zamanı 23% metil etil keton alınır və sirkə turşusu alınır. Əsas sənaye üsulu isə butilen fraksiyasının üç mərhələli işlənməsidir hansı ki, sintetik kauçuk zavodunda divinil istehsalında yan məhsul kimi istifadə olunur.
Metil etil keton toksiki maddədir. Bədənə dəri vasitəsilə daxil ola bilər; gözlərə, dəriyə, mərkəzi sinir sistemininə, tənəffüs yollarına zədə verə bilər. 3-5 dəqiqə ərzində 1 mq / l konsentrasiyasında bir insana gözlərin, burun və boğazın selikli qişasının qıcıqlanması -na səbəb olur, 30 mq / l - qıcıqlanma dözülməz hala gəlir.

Kadmium(II)xlorid
Kadmium (II) xlorid (CdCl2) — qeyri-üzvi bir birləşmədir, kadmium metalının və xlorid turşusunun duzu, rəngsizkristallar, higroskopik, suda asanlıqla həll olunur,
kristallohidratlar əmələ gətirir.
Kadmium (II) xlorid heksoqonal sistemin rəngsiz
kristallarını, fəza qrupunu R-3m, hüceyrə parametrlərini a = 0.385 nm, c = 1.746 nm, Z = 3 əmələ gətirir. Sulu məhlulları hidrolizə görə turş reaksiya yaradır. Metalik kadmium(6000C-də kadmiumun~ 15%) kadmium xloridin ərintisində həll olunur.
Metalik kadmiumun xlorid turşusunda həll edilməsi nəticəsində almaq olur:
C
d
+
2
H
C
l
→
τ
C
d
C
l
2
+
H
2
↑
{\displaystyle {\mathsf {Cd+2HCl\ {\xrightarrow {\tau }}\ CdCl_{2}+H_{2}\uparrow }}}
Kadmium oksidin xlorid turşusunda həll edilməsi:
C
d
O
+
2
H
C
l
→
C
d
C
l
2
+
H
2
O
{\displaystyle {\mathsf {CdO+2HCl\ {\xrightarrow {}}\ CdCl_{2}+H_{2}O}}}
Sadə maddələr arasındakı reaksiya nəticəsində:
C
d
+
C
l
2
→
450
−
500
o
C
C
d
C
l
2
{\displaystyle {\mathsf {Cd+Cl_{2}\ {\xrightarrow {450-500^{o}C}}\ CdCl_{2}}}}
Kadmium oksidin və xlor qazı ilə reaksiyası nəticəsində:
2
C
d
O
+
2
C
l
2
→
500
−
600
o
C
2
C
d
C
l
2
+
O
2
{\displaystyle {\mathsf {2CdO+2Cl_{2}\ {\xrightarrow {500-600^{o}C}}\ 2CdCl_{2}+O_{2}}}}
Kristallohidratların qızdırılması nəticəsində susuz duzları alınır:
C
d
C
l
2
⋅
2
,
5
H
2
O
→
120
−
170
o
C
C
d
C
l
2
+
2
,
5
H
2
O
{\displaystyle {\mathsf {CdCl_{2}\cdot 2,5H_{2}O\ {\xrightarrow {120-170^{o}C}}\ CdCl_{2}+2,5H_{2}O}}}
Hidrogen xloridlə və qələvi metal xloridlərlə kompleks yaradır:
C
d
C
l
2
+
2
H
C
l
→
H
2
[
C
d
C
l
4
]
{\displaystyle {\mathsf {CdCl_{2}+2HCl\ {\xrightarrow {}}\ H_{2}[CdCl_{4}]}}}
C
d
C
l
2
+
2
K
C
l
→
K
2
[
C
d
C
l
4
]
↓
{\displaystyle {\mathsf {CdCl_{2}+2KCl\ {\xrightarrow {}}\ K_{2}[CdCl_{4}]\downarrow }}}
Qaynar qatı sulfat turşusu ilə reaksiyaya daxil olur:
C
d
C
l
2
+
H
2
S
O
4
→
100
o
C
C
d
S
O
4
+
2
H
C
l
↑
{\displaystyle {\mathsf {CdCl_{2}+H_{2}SO_{4}\ {\xrightarrow {100^{o}C}}\ CdSO_{4}+2HCl\uparrow }}}
Qələvilərlə reksiyaya daxil olur:
C
d
C
l
2
+
2
N
a
O
H
→
C
d
(
O
H
)
2
+
2
N
a
C
l
{\displaystyle {\mathsf {CdCl_{2}+2NaOH\ {\xrightarrow {}}\ Cd(OH)_{2}+2NaCl}}}
Fotoreagentlərdə.
Qalvanik elementlərdə elektrolitin tərkib hissəsi kimi.
Üzvi sintezdə katalizator kimi.
Sənayedə günəş panellərinin istehzalı zamanı.
Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр.

Titan(III)xlorid
Titan (III) xlorid (TiCl3) - qeyri-üzvi bir birləşmədir, titanın və xlorid turşusunun duzudur, tünd bənövşəyi kristallar, suda həll olur, yavaş-yavaş havada oksidləşir,
kristallohidrat əmələ gətirir.
Titan (III) xlorid triqonal sistemin tünd bənövşəyi kristallarını əmələ gətirir.
TiCl3-ün β-modifikasiyası məlumdur - qəhvəyi kristallardı. TiCl3•6H2O kristallohidrat yaradır, onunda hidrat izomerləri
[Ti (H2O)6] Cl3 (bənövşəyi), [Ti (H2O)5Cl]Cl2•H2O (yaşıl)
və [Ti (H2O)4Cl2] Cl • 2H2O(yaşıl) mövcuddur.
Titanın qatı isti xlor turşusunda həll edilməsi nəticəsində almaq olar:
2
T
i
+
6
H
C
l
→
90
o
C
2
T
i
C
l
3
+
3
H
2
↑
{\displaystyle {\mathsf {2Ti+6HCl\ {\xrightarrow {90^{o}C}}\ 2TiCl_{3}+3H_{2}\uparrow }}}
Titan(II)xloridin durulaşdırılmış xlor turşusunda həll edilməsi nəticəsində:
2
T
i
C
l
2
+
2
H
C
l
→
2
T
i
C
l
3
+
H
2
↑
{\displaystyle {\mathsf {2TiCl_{2}+2HCl\ {\xrightarrow {}}\ 2TiCl_{3}+H_{2}\uparrow }}}
Titan xloridin hidrogen ilə reduksiya nəticəsində:
2
T
i
C
l
4
+
H
2
→
500
o
C
2
T
i
C
l
3
+
2
H
C
l
{\displaystyle {\mathsf {2TiCl_{4}+H_{2}\ {\xrightarrow {500^{o}C}}\ 2TiCl_{3}+2HCl}}}
Titan (IV) xloridin titan ilə reduksiya nəticəsində alınır:
3
T
i
C
l
4
+
T
i
→
500
o
C
4
T
i
C
l
3
{\displaystyle {\mathsf {3TiCl_{4}+Ti\ {\xrightarrow {500^{o}C}}\ 4TiCl_{3}}}}
Titan (IV) xloridin elektrolizi ilə reduksiyası:
2
T
i
C
l
4
→
e
−
2
T
i
C
l
3
+
C
l
2
↑
{\displaystyle {\mathsf {2TiCl_{4}\ {\xrightarrow {e^{-}}}\ 2TiCl_{3}+Cl_{2}\uparrow }}}
TiCl3 suda, etanolda yaxşı həll olur, dietil etirində, benzolda həll olunmur. Maye ammonyak ilə komplekslər əmələ gətirir [Ti(NH3)6]Cl3 və TiCl3 • 2NH3.
Qızdırılıqda parçalanır
2
T
i
C
l
3
→
440
−
700
o
C
T
i
C
l
2
+
T
i
C
l
4
{\displaystyle {\mathsf {2TiCl_{3}\ {\xrightarrow {440-700^{o}C}}\ TiCl_{2}+TiCl_{4}}}}
Inert atmosferdə qələvilərlə reaksiyaya girir:
T
i
C
l
3
+
3
N
a
O
H
→
N
2
T
i
(
O
H
)
3
↓
+
3
N
a
C
l
{\displaystyle {\mathsf {TiCl_{3}+3NaOH\ {\xrightarrow {N_{2}}}\ Ti(OH)_{3}\downarrow +3NaCl}}}
Havada reaksiya fərqli gedir:
2
T
i
C
l
3
+
6
N
a
O
H
+
O
2
→
2
T
i
O
(
O
H
)
2
↓
+
6
N
a
C
l
+
H
2
O
2
{\displaystyle {\mathsf {2TiCl_{3}+6NaOH+O_{2}\ {\xrightarrow {}}\ 2TiO(OH)_{2}\downarrow +6NaCl+H_{2}O_{2}}}}
Turş mühitdə oksidləşir:
4
T
i
C
l
3
+
O
2
+
4
H
C
l
+
6
H
2
O
→
P
t
4
[
T
i
(
H
2
O
)
2
C
l
4
]
{\displaystyle {\mathsf {4TiCl_{3}+O_{2}+4HCl+6H_{2}O\ {\xrightarrow {Pt}}\ 4[Ti(H_{2}O)_{2}Cl_{4}]}}}
Sulu məhlulu tədricən havada və neytral mühitdə oksidləşir:
4
T
i
C
l
3
+
O
2
+
2
H
2
O
→
4
T
i
O
C
l
2
+
4
H
C
l
{\displaystyle {\mathsf {4TiCl_{3}+O_{2}+2H_{2}O\ {\xrightarrow {}}\ 4TiOCl_{2}+4HCl}}}
Qələvi metalların xloridləri ilə kompleks duzlar əmələ gətirir:
T
i
C
l
3
+
2
K
C
l
→
K
2
[
T
i
(
H
2
O
)
C
l
5
]
{\displaystyle {\mathsf {TiCl_{3}+2KCl\ {\xrightarrow {}}\ K_{2}[Ti(H_{2}O)Cl_{5}]}}}
TiCl3, Tsiqler-Natta katalizatorun əsas hissəsidir, hansı ki, sənayedə polietilenin istehsalında məsul yer tutur. Üzvi sintezdə reagent kimi istifadə olunur.
Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр.

Vanadium (IV)xlorid
Vanadium IV xlorid – qeyri-üzvi birləşmədir, xlorid turşusunun və vanadium metalının duzudur .
Vanadium (IV) xlorid tünd qırmızı rəngli bir mayedir.Soyuq su ilə qarışmır, isti su ilə reaksiyaya daxil olur. Etanolda, dietil efirində, xloroformda həll olunur. Nəm
havada tüstülənir.
Çar arağında həll olması nəticəsində alınır:
3
V
+
12
H
C
l
+
4
H
N
O
3
→
3
V
C
l
4
↓
+
4
N
O
↑
+
8
H
2
O
{\displaystyle {\mathsf {3V+12HCl+4HNO_{3}\ {\xrightarrow {}}\ 3VCl_{4}\downarrow +4NO\uparrow +8H_{2}O}}}
Vanadiumun xlorla reaksiyası:
V
+
2
C
l
2
→
200
−
350
o
C
V
C
l
4
↓
{\displaystyle {\mathsf {V+2Cl_{2}\ {\xrightarrow {200-350^{o}C}}\ VCl_{4}\downarrow }}}
İnert atmosferdə qızdırıldıqda vanadium (III) xloridin parçalanması:
2
V
C
l
3
→
400
−
500
o
C
,
N
2
V
C
l
4
+
V
C
l
2
{\displaystyle {\mathsf {2VCl_{3}\ {\xrightarrow {400-500^{o}C,N_{2}}}\ VCl_{4}+VCl_{2}}}}
Dioksivanadium(V)xloridin qatı xlorid turşusunda həll edilməsi nəticəsində:
2
V
O
2
C
l
+
8
H
C
l
→
5
o
C
2
V
C
l
4
+
C
l
2
↑
+
4
H
2
O
{\displaystyle {\mathsf {2VO_{2}Cl+8HCl\ {\xrightarrow {5^{o}C}}\ 2VCl_{4}+Cl_{2}\uparrow +4H_{2}O}}}
Otaq temperaturunda parçalanır:
2
V
C
l
4
→
2
V
C
l
3
+
C
l
2
{\displaystyle {\mathsf {2VCl_{4}\ \xrightarrow {\ } 2VCl_{3}+Cl_{2}}}}
Havanın nəmi ilə reaksiyaya girir:
V
C
l
4
+
H
2
O
→
V
O
C
l
2
+
2
H
C
l
{\displaystyle {\mathsf {VCl_{4}+H_{2}O\ {\xrightarrow {}}\ VOCl_{2}+2HCl}}}
İsti su ilə reaksiyaya daxil olaraq mavi rəngdə məhlullar yaradır:
V
C
l
4
+
8
H
2
O
→
100
o
C
[
V
(
H
2
O
)
5
O
]
2
+
+
4
C
l
−
+
2
H
3
O
+
{\displaystyle {\mathsf {VCl_{4}+8H_{2}O\ {\xrightarrow {100^{o}C}}\ [V(H_{2}O)_{5}O]^{2+}+4Cl^{-}+2H_{3}O^{+}}}}
Qatı sulfat turşusu ilə reaksiyaya daxil olaraq qəhvəyi rəngdə heksaxlorvanadium turşusu alınır:
V
C
l
4
+
2
H
C
l
→
H
2
[
V
C
l
6
]
{\displaystyle {\mathsf {VCl_{4}+2HCl\ {\xrightarrow {}}\ H_{2}[VCl_{6}]}}}
Qatı azot turşusu ilə oksidləşir:
V
C
l
4
+
2
H
N
O
3
+
H
2
O
→
V
O
2
C
l
+
N
O
2
↑
+
3
H
C
l
{\displaystyle {\mathsf {VCl_{4}+2HNO_{3}+H_{2}O\ {\xrightarrow {}}\ VO_{2}Cl+NO_{2}\uparrow +3HCl}}}
Qələvilərlə reaksiyaya daxil olur:
V
C
l
4
+
4
N
a
O
H
→
V
O
(
O
H
)
2
↓
+
4
N
a
C
l
+
H
2
O
{\displaystyle {\mathsf {VCl_{4}+4NaOH\ {\xrightarrow {}}\ VO(OH)_{2}\downarrow +4NaCl+H_{2}O}}}
Hidrogen və ya vanadiumla reduksiya olunur:
V
C
l
4
+
H
Z
n
,
H
C
l
0
→
τ
V
C
l
3
+
H
C
l
{\displaystyle {\mathsf {VCl_{4}+H_{Zn,HCl}^{0}\ {\xrightarrow {\tau }}\ VCl_{3}+HCl}}}
2
V
C
l
4
+
H
2
→
500
−
600
o
C
2
V
C
l
2
+
2
H
C
l
{\displaystyle {\mathsf {2VCl_{4}+H_{2}\ {\xrightarrow {500-600^{o}C}}\ 2VCl_{2}+2HCl}}}
3
V
C
l
4
+
V
→
320
−
400
o
C
4
V
C
l
3
{\displaystyle {\mathsf {3VCl_{4}+V\ {\xrightarrow {320-400^{o}C}}\ 4VCl_{3}}}}
Kalium xloridlə reaksiyayı
V
C
l
4
+
2
K
C
l
→
400
o
C
K
2
[
V
C
l
6
]
{\displaystyle {\mathsf {VCl_{4}+2KCl\ {\xrightarrow {400^{o}C}}\ K_{2}[VCl_{6}]}}}
Vanadium IV xlorid üzvi sintezdə xlorlaşdırıcı maddə kimi istifadə olunur.
Рабинович В.А., Хавин З.Я. "Краткий химический справочник" Л.: Химия, 1977 стр. 58
Справочник химика / Редкол.: Никольский Б. П. и др.. — 3-е изд. Химия, 1971. Т. 2.

Volfram (VI)xlorid
Volfram (VI) xlorid – qeyri-üzvi birləşmə, volfram və xlorid turşusunun duzudur.
Volfram (VI) xlorid tünd bənövşəyi kristallardı.180 °C-ə qədər olan temperaturda α-modifikasiyası sabitdir, triqonal sistem, hüceyrə parametrləri
a = 0,658 nm, α = 55°-dir. Spirtlərdə, efirdə, benzolda, karbon disulfiddə, karbon tetraxloriddəhəll olunur.
1. Volfram və xlorun reaksiyası nəticəsində alınır:
W
+
3
C
l
2
→
500
−
800
o
C
W
C
l
6
{\displaystyle {\mathsf {W+3Cl_{2}\ {\xrightarrow {500-800^{o}C}}\ WCl_{6}}}}
2. Tetraxlormetanın volfram(VI) oksidə təsiri nəticəsində:
W
O
3
+
3
C
C
l
4
→
450
o
C
,
p
W
C
l
6
+
3
C
C
l
2
O
{\displaystyle {\mathsf {WO_{3}+3CCl_{4}\ {\xrightarrow {450^{o}C,p}}\ WCl_{6}+3CCl_{2}O}}}
1. Qızdırıldıqda parçalanır:
2
W
C
l
6
→
350
o
C
2
W
C
l
5
+
C
l
2
{\displaystyle {\mathsf {2WCl_{6}\ {\xrightarrow {350^{o}C}}\ 2WCl_{5}+Cl_{2}}}}
2. Su ilə reaksiyaya daxil olur:
2
W
C
l
6
+
3
H
2
O
→
W
O
C
l
4
+
W
O
2
C
l
2
+
6
H
C
l
{\displaystyle {\mathsf {2WCl_{6}+3H_{2}O\ {\xrightarrow {}}\ WOCl_{4}+WO_{2}Cl_{2}+6HCl}}}
W
C
l
6
+
3
H
2
O
→
W
O
3
↓
+
6
H
C
l
{\displaystyle {\mathsf {WCl_{6}+3H_{2}O\ {\xrightarrow {}}\ WO_{3}\downarrow +6HCl}}}
3. Durulaşdırılmış qələvilərlə reaksiyaya daxil olur:
W
C
l
6
+
8
N
a
O
H
→
N
a
2
W
O
4
+
6
N
a
C
l
+
4
H
2
O
{\displaystyle {\mathsf {WCl_{6}+8NaOH\ {\xrightarrow {}}\ Na_{2}WO_{4}+6NaCl+4H_{2}O}}}
4. Hidrogenlə reduksiya olunur:
2
W
C
l
6
+
H
2
→
150
−
200
o
C
2
W
C
l
5
+
2
H
C
l
{\displaystyle {\mathsf {2WCl_{6}+H_{2}\ {\xrightarrow {150-200^{o}C}}\ 2WCl_{5}+2HCl}}}
3
W
C
l
6
+
2
A
l
→
450
o
C
3
W
C
l
4
+
2
A
l
C
l
3
{\displaystyle {\mathsf {3WCl_{6}+2Al\ {\xrightarrow {450^{o}C}}\ 3WCl_{4}+2AlCl_{3}}}}
5. Hidrogen floridlə reaksiyaya daxil olur:
6. Volfram(VI) oksidlə reaksiyaya daxil our:
W
C
l
6
+
6
H
F
→
t
W
F
6
+
6
H
C
l
{\displaystyle {\mathsf {WCl_{6}+6HF\ {\xrightarrow {t}}\ WF_{6}+6HCl}}}
W
C
l
6
+
2
W
O
3
→
400
o
C
3
W
O
2
C
l
2
{\displaystyle {\mathsf {WCl_{6}+2WO_{3}\ {\xrightarrow {400^{o}C}}\ 3WO_{2}Cl_{2}}}}
7. Üzvi volfram birləşmələrinin sintezi üçün xammal kimiistifadə olunur. Məsələn, dimetilcivə ilə reaksiyaya girərək metilpentaxlorvolfram alınır:
Volfram (VI) xlorid qeyri-metal səthlərdə örtük kimi istifadə olunur.
Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.

Molibden (V) xlorid
Molibden (V) xlorid kimyəvi formulu MoCl5 olan qeyri-üzvi birləşmədir, molibden və xlorid turşusunun duzudur.
Molibden (V) xlorid monoklinik sinqoniyanın qara hiqroskopik kristallarını əmələ gətirir, fəza qrupu C 2/m. Dietil efirində, spirtlərdə, tetraxlormetanda, xloroformda, dixloretanda həll olunur.
Toz şəklində olan molibdenin və xlorun reaksiyası nəticəsində almaq olar:
2
M
o
+
5
C
l
2
→
400
−
500
o
C
2
M
o
C
l
5
{\displaystyle {\mathsf {2Mo+5Cl_{2}\ {\xrightarrow {400-500^{o}C}}\ 2MoCl_{5}}}}
Teraxlormetanın molibden (V) oksidin reaksiyası nəticəsində:
2
M
o
O
3
+
3
C
C
l
4
→
240
o
C
2
M
o
C
l
5
+
C
l
2
+
3
C
O
2
{\displaystyle {\mathsf {2MoO_{3}+3CCl_{4}\ {\xrightarrow {240^{o}C}}\ 2MoCl_{5}+Cl_{2}+3CO_{2}}}}
Yüksək temperaturda qızıdırıldıqda atmosferdə parçalamır:
M
o
C
l
5
→
>
268
o
C
M
o
C
l
3
+
C
l
2
{\displaystyle {\mathsf {MoCl_{5}\ {\xrightarrow {>268^{o}C}}\ MoCl_{3}+Cl_{2}}}}
NO_2\uparrow + 5HCl\uparrow }</math>
Hava rütubəti ilə reaksiya daxil olur:
M
o
C
l
5
+
H
2
O
→
M
o
C
l
3
O
+
2
H
C
l
{\displaystyle {\mathsf {MoCl_{5}+H_{2}O\ {\xrightarrow {}}\ MoCl_{3}O+2HCl}}}
Su ilə reaksiyası:
2
M
o
C
l
5
+
5
H
2
O
→
M
o
O
(
O
H
)
3
↓
+
H
2
[
M
o
C
l
5
O
]
+
5
H
C
l
{\displaystyle {\mathsf {2MoCl_{5}+5H_{2}O\ {\xrightarrow {}}\ MoO(OH)_{3}\downarrow +H_{2}[MoCl_{5}O]+5HCl}}}
İsti qatı nitrat turşusu ilə reaksiyası:
Qatı qəlivələrlə reaksiyası:
::
M
o
C
l
5
+
5
N
a
O
H
→
M
o
O
(
O
H
)
3
↓
+
5
N
a
C
l
+
H
2
O
{\displaystyle {\mathsf {MoCl_{5}+5NaOH\ {\xrightarrow {}}\ MoO(OH)_{3}\downarrow +5NaCl+H_{2}O}}}
Qızdırdıqda hava ilə oksidləşir:
::
2
M
o
C
l
5
+
O
2
→
200
o
C
2
M
o
C
l
4
O
+
C
l
2
{\displaystyle {\mathsf {2MoCl_{5}+O_{2}\ {\xrightarrow {200^{o}C}}\ 2MoCl_{4}O+Cl_{2}}}}
Hidrogenlə 900 °C-də molibdenə və 250 °C-də molibden (III) xloridə qədər reduksiya olunur:
2
M
o
C
l
5
+
5
H
2
→
900
o
C
2
M
o
+
10
H
C
l
{\displaystyle {\mathsf {2MoCl_{5}+5H_{2}\ {\xrightarrow {900^{o}C}}\ 2Mo+10HCl}}}
M
o
C
l
5
+
H
2
→
250
o
C
M
o
C
l
3
+
2
H
C
l
{\displaystyle {\mathsf {MoCl_{5}+H_{2}\ {\xrightarrow {250^{o}C}}\ MoCl_{3}+2HCl}}}
Natrium sulfid ilə molibden disulfidə qədər reduksiya olunur:
::
2
M
o
C
l
5
+
5
N
a
2
S
→
2
M
o
S
2
+
10
N
a
C
l
+
S
{\displaystyle {\mathsf {2MoCl_{5}+5Na_{2}S\ {\xrightarrow {}}\ 2MoS_{2}+10NaCl+S}}}
Molibden (V) xlorid molibden tozlarının hazırlanmasinda, qeyri-metal səthlərə molibden örtüyünün tətbiqində istifadə olunur.
Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
Неорганическая химия / под ред.