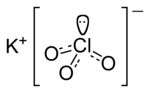



















сущ. хим., геол. хлорит; xloritlər хлориты: 1. группа слюдоподобных минералов зеленоватого цвета, входящих в состав многих горных пород 2. соли хлорис
Tam oxu »сущ. хим. хлорал (бесцветная маслянистая жидкость с резким запахом, получаемая хлорированием спирта, наркотическое и болеутоляющее средство)
Tam oxu »




















сущ. хлоратор: 1. аппарат для дозирования газообразного хлора и приготовления его водного раствора 2. аппарат, используемый в химической технологии дл
Tam oxu »хим. I сущ. хлорид; xloridlər хлориды (химические соединения хлора с другими элементами) II прил. хлористый. Mis 1-xlorid хлористая медь (I), civə 1-x
Tam oxu »is. Yuqoslaviyanın tərkibinə daxil olan Xorvatiyanın əsas əhalisini təşkil edən cənubi slavyan xalqı və bu xalqa mənsub adam
Tam oxu »...Хорватии 2. лица, относящиеся к этой нации II прил. хорватский. Xorvat dili хорватский язык, xorvat ədəbiyyatı хорватская литература, xorvat xalqı хо
Tam oxu »I (Ağdam) satqın. – Ə:, nə xoryat adammış, gedif Qaracadan sədriyə şikə:t eliyif II (Ağdam, Balakən) çirkin, kifir. – Yox ə:, xoryatın biridi, sir-sif
Tam oxu »...yoxdur, qızıl güldən təzəsən, Yer hay, məlum, təzəsən, broy! Sənə xoryat əli dəydi, sol sonam! Bol, broy, broy! (M.Elyas. “Nəğmələr kitab
Tam oxu »...dala qonaram, Zərgərəm, gümüş yonaram, Ha bu dərdə mən yanaram, Xoryat söz məni dağladı. (“Abbas və Gülgəz”) * M
Tam oxu »...ehsan. Dedi ki, mən edən zamanda vəfat; Dəfn edin, verməyin mənə xeyrat. S.Ə.Şirvani. …Elə bunu götürək ki, bu axır vaxtlarda başlayıbsınız nuxalılar
Tam oxu »...подаваемая на таком обеде 2. благотворительность, благодеяние; xeyrat vermək: 1. устраивать поминки; 2. оказывать помощь с благотворительной целью; с
Tam oxu »[ər.] сущ. дин. хайрат, игьсан, гъуьйуьф (кьейи касдин тӀварцӀелай гудай); суваб патал гудай пул, тӀуьн ва мс
Tam oxu »ə. 1) rifah, nemət; 2) dövlət, sərvət, var; 3) yaxşı iş(lər); yaxşılıq; 4) xeyriyyəçilik iş(lər)i; 5) ehsan
Tam oxu »is. Ağac və taxtadan müxtəlif şeylər qayıran usta; doğramaçı. Bir yanda xarratlar taxta yonub rəndələyir, qapı-pəncərənin çərçivəsini yerinə salır, dö
Tam oxu »...работах). Xarrat işləmək работать столяром II прил. столярный. Xarrat yapışqanı столярный клей
Tam oxu »I. i. joiner; carpenter II. s. joiner’s ~ emalatxanası joiner’s shop; ~ sənəti / işi joinery, joiner’s work; ~ dəzgahı joiner’s bench; ~ yapışqanı joi
Tam oxu »сущ. дерлик, харрат (кӀарасдикай, кьулуникай жуьреба-жуьре затӀар расдай устӀар, кӀарасдин устӀар).
Tam oxu »XARRAT (taxtadan daha zərif şeylər – döşəmə, tavan düzəldən usta) Neyləyim dolana bilmirəm atam; Qolu gücdən düşən nasaz xarratam (M.Rahim); DÜLGƏR (q
Tam oxu »[yun.] bot. Bitkilərdə: yarpaqlarda və zoğlarda yaşıl rəngin çatışmazlığından törəyən xəstəlik hal
Tam oxu »сущ. бот. хлороз: 1. болезнь растений, при которой нарушается образование хлорофилла в листьях, появляется желтизна 2
Tam oxu »[yun.] бот. хлороз (набататрин пешерик ва кьенерик къацу ранг тахьун; набататрин азар).
Tam oxu »...содержащий хлор) 2. хлорный (содержащий хлор). Xlorlu əhəng хлорная известь, xlorlu su хлорная вода
Tam oxu »s. kim. chlorous, chloric, chlorinated; ~ əhəng chloride of lime, bleaching powder; ~ turşu chlorous acid
Tam oxu »прил. kim. 1. xlor -i[-ı]; хлорная кислота xlor turşusu; 2. xlorlu; хлорная известь xlorlu əhəng.
Tam oxu »...михьиз дегишрун, чIурун (мес. эцигнавай къайда, яшайишдин тегьер). ♦ сломать себе шею см. шея.
Tam oxu »несов., разг. ягъалмишвал авун; гъалатI авун; усалвал авун; кар чIур жедайвал авун
Tam oxu »...квайда хьиз тадиз тIуьн; тадиз хъун. 2. пер. фад-фад ва гзаф кIелун. ♦ глотать слова гафар туькьуьнун, ачухдиз лугьун тавун; глотать слѐзы шел кIев
Tam oxu »несов. 1. саралай авун, сараралди къадгъунун, жакьун (мес. кицIи кIараб). 2. пер. гьамиша гъуьнтI гун, хурук кутун (гъургъур ийиз, рахаз, дяве ийиз
Tam oxu »...лархъна акьалун; лархъна акьал хьун (мес. рак). 3. капар ягъун; хлопать артисту артистдиз капар ягъун. 4. ван авун; ван ийиз тун; баргъ авун; къумп
Tam oxu »сущ. хим. хлораты (соли хлорноватой кислоты; применяются как окислители, гербициды и т.д.)
Tam oxu »