


















м etn. kalım, başlıq (keçmişdə Orta Asiya xalqlarında evlənərkən qızın ata-anasına oğlanın verdiyi pul və ya mal).
Tam oxu »-а; м. (от тат. kalyn) 1) У некоторых народов Востока: обычай платить выкуп за невесту её родителям (первоначально - её роду); сам такой выкуп. 2) раз
Tam oxu »is. etnoqr. Orta Asiyada: evlənərkən oğlanın qızın ata-anasına verməli olduğu pul, mal və s.; başlıq və bu adətin özü
Tam oxu »сущ. этногр. калым (Юкьван Азияда: мехъерзавай гадади рушан диде-бубадиз гун лазим тир пул, мал ва мс.; вегьидай пул, рехъ: гьа адет вич).
Tam oxu »




















...[fars.] Yun və ya pambıqdan toxunan zolaqlı, xovsuz palaz növü. Kilimə bürün, el ilə sürün. (Ata. sözü). Qadınların kimisi yun darayır, ip əyirir, ki
Tam oxu »...ручной работы), палас. Naxışlı kilim узорчатый килим, kilim toxumaq ткать, соткать килим, kilim döşəmək (sərmək) расстилать, расстелить килим
Tam oxu »[fars.] сущ. рух (сун ва я памбагин гъаларикай зулар аваз хранвай чӀичӀ авачир жижим).
Tam oxu »несов. 1. qızartmaq, közərtmək, qızdırmaq; калить железо dəmiri qızartmaq; 2. qovurmaq; калить орехи qozu (fındığı) qovurmaq; 3. xüs. su vermək (metal
Tam oxu »несов. 1. гзаф ифирун, къизмишрун, яру авун (ракь). 2. чурун (цIал, цIук шабалтар, кIерецар)
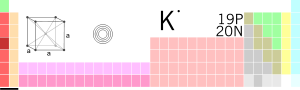
Tam oxu »[lat. əsli ər. əlkali] kim. Qələvi filizlər qrupundan gümüşü-ağ rəngli metal – kimyəvi element.
Tam oxu »I сущ. хим. калий (химический элемент из группы щелочных металлов серебристо-белого цвета) II прил. 1. калиевый (относящийся к калию, содержащий в себ
Tam oxu »...yeyib zəhərlənmək (mal-qara haqqında). – Bostanın ətrafını kalış basmışdı. İ.Şıxlı. 2. məh. Göy, təzə (soğan haqqında). Kalış soğan, qırmızı turp, mü
Tam oxu »...травянистое растение сем. злаков, сорняк) II прил. диал. свежий, зеленый. Kalış soğan зеленый лук
Tam oxu »сущ. 1. бот. калыш, нацӀуниз ухшар кӀаламар алай са хъач; 2. пер. къацу, цӀийи (чичӀег).
Tam oxu »...сагъ затӀунин паяр сад-садав галкӀизвай чка. Гьар са тупӀал пуд кӀалам ала. Р. Синоним: жалгъа.
Tam oxu »къалум хьун гл., низ, вуч жаза агакьун. Урусатдин кӀеви зулум, Са къуз адаз жеда къалум. Е. Э. 1877 - йисан бунтариз. Кайвани, тӀуб сара кьуна, зи к
Tam oxu »...Б. Гь. Заз эвера. Гьа кӀ ятӀани, къунши райондин майишатри къалин тамар кукӀварна КцӀар вацӀун яд Къубадиз тухуз алахънава. М. М. Лезги тӀвар алатӀ
Tam oxu »|| КЪАДИМИ араб, ктаб, прил. 1) фадлай авай. # ~ дарамат, ~ девирар, ~ халкь, ~ хуьр, ~ шегьер, ~ муьгъ; ~ адет( ар), ~ кхьинар. Яраб чкадин халкьар
Tam oxu »...гл., ни каламдин тӀвар кьуна кьин кьун. * калам къалум хьуй! межд. жува лугьузвай гафарин дуьзвал, гъахълувал къалурун патал ишлемишдай ибара.
Tam oxu »...с.-х. укос: 1. количество проведённого укоса. Bir ildə iki çalım keçirmək (aparmaq) провести два укоса в год 2. количество скошенной травы, сена. İll
Tam oxu »...sağlıq, dirilik. Dəli könlüm, məndən sənə əmanət; Demə bu dünyada qalım yaxşıdır. Xəstə Qasım.
Tam oxu »bir salım – az, azacıq; bir dəfə tökməyə, salmağa çatar. Bir salım çay. Bir salım ədvə. – O, düşəndə qonşusuna bir salım duz, yarım sərnic ayran verib
Tam oxu »1 в сочет. с числ. bir salım (одна) щепотка чего-л., рассчитанная на один раз. Bir salım чай щепотка чая (чаю), iki salım duz две щепотки соли 2 сущ.
Tam oxu »...edən, zülmkar, qəddar, mərhəmətsiz, insafsız. Zalım padşah. Zalım istismarçılar. – Mən görmüşəm, kafirim də görməsin; Nə yaman dərd imiş zalım ayrılı
Tam oxu »1. жестокий, бесчеловечный, безжалостный, бессердечный; 2. мучитель, угнетатель, деспот, тиран;
Tam oxu »I. i. cruel man* / person; (zülmkar) oppressor, despot, tyrant II. s. cruel; brutal; ruthless, hard-hearted; (zülmkar) despotic, tyrannical, tyrannous
Tam oxu »ZALIM [Tağı:] Bəradər, mən deyəndə ki, .. padşah zalın idi, onun zamanında dədəm yazığın köynəyinin boynu barmaq qalınlığında çirk bağlamışdı, siz nə
Tam oxu »...klas. 1. Salamat. Tək-tək ayılan varsa da, haqq dadıma çatsın; Mən salim olum, cümlə cahan batsa da batsın. M.Ə.Sabir. 2. Dinc, sakit, əmin. Başmaqçı
Tam oxu »...здоровый, невредимый, целый; salim olmaq быть живым и здоровым. Mən salim olum, cümlə-cahan batsa da batsın (M. Ə. Sabir) лишь бы я был жив и здоров,
Tam oxu »...разг.-сниж. выполнять какую-л. работу, оказывать услуги кому-л. за калым 2); подрабатывать.
Tam oxu »...его ребёнком 2) долг, обязанности, чувства отца 2. устар. диал. калым, выкуп, отдаваемый женихом родителям невесты 3. отчим II прил. 1. отцовский, ро
Tam oxu »...тех. головка. Başlığı gizlənən vint винт с потайной головкой 2 сущ. калым (в прошлом: деньги, вещи, полученные родителями невесты от жениха перед сва
Tam oxu »