






























несов. 1. qızartmaq, közərtmək, qızdırmaq; калить железо dəmiri qızartmaq; 2. qovurmaq; калить орехи qozu (fındığı) qovurmaq; 3. xüs. su vermək (metal
Tam oxu »-лю, -лишь; калённый; -лён, -лена, -лено; нсв. см. тж. калиться, каление что 1) а) Сильно нагревать, доводить до раскалённого состояния. Калить камни
Tam oxu »несов. 1. гзаф ифирун, къизмишрун, яру авун (ракь). 2. чурун (цIал, цIук шабалтар, кIерецар)
Tam oxu »































сущ. геол. кальцит (минерал, природный углекислый кальций, составная часть мрамора, известняка и др.)
Tam oxu »I сущ. капитель: 1. архит. верхняя часть колонны или пилястра, служащая непосредственным переходом к покрытию 2. типогр. шрифт, буквы которого имеют н
Tam oxu »сущ. каратэ: 1. японская система защиты без оружия, основанная на ударах рукой или ногой по наиболее чувствительным местам тела противника 2. спорт. в
Tam oxu »[fr.] 1. Budka şəklində kiçik otaq. Səsvermə kabinəsi. Pilot kabinəsi. Yük maşınının kabinəsi. Telefon kabinəsi
Tam oxu »сущ. кабина (небольшое помещение специального назначения). Təyyarəçi kabinəsi кабина летчика, kosmik gəmi kabinəsi кабина космического корабля, ekskav
Tam oxu »i. booth; (yük maşınında) cab; (liftdə) lift car; pilot ~si cockpit, cabin; seçki / səsvermə ~si polling booth
Tam oxu »[fr.] 1. xüs. Silah lüləsi diametrinin ölçüsü; çap. Kalibri böyük toplar. // Mərmi və ya güllənin diametri
Tam oxu »I сущ. тех. воен. калибр: 1. диаметр канала ствола огнестрельного оружия, орудия 2. диаметр снаряда или пули 3. точный, определенный размер каких-нибу
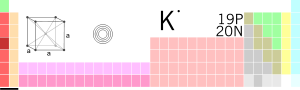
Tam oxu »[lat. əsli ər. əlkali] kim. Qələvi filizlər qrupundan gümüşü-ağ rəngli metal – kimyəvi element
Tam oxu »I сущ. хим. калий (химический элемент из группы щелочных металлов серебристо-белого цвета) II прил. 1. калиевый (относящийся к калию, содержащий в себ
Tam oxu »м kalibr, Ölçü (1. silah lüləsi diametrinin ölçüsü; 2. çox istehsal edilən şeylərin böyük-kiçikliyini müəyyən etmək üçün əndazə).
Tam oxu »м köhn. 1. zəvvar, ziyarətçi, yolçu; 2. dilənçi; ◊ калики перехожие sərsəri (kor) xanəndələr (rus dastanlarında).
Tam oxu »is. [ər.] Qadın (qız) katib. Qüdrətin qarabuğdayı katibəsi sürətlə şığıyıb içəri girdi. M.Hüseyn. Narınc çox kobud bir şəkildə katibəyə cavab verdi… S
Tam oxu »...гъалар. 2. пер. шудургъа, силиста; гьавайда вахт пучун; тянуть канитель буш кардал гьавайда вахт пучун.
Tam oxu »f. 1) müşk və ənbərdən düzəldilib qaşa və saça sürtülən ətirli qara yağ; 2) ətirli, rayihəli; 3) s. qara
Tam oxu »...tərəfinə doluş(du)… M.İbrahimov. Onun boyu az uzun, şalvarı az qalife, çənəsi az yastı, bədəni arıqdır. Qantəmir. Şahnaz onun [Qurbanın] corablarını
Tam oxu »сущ. галифе (брюки, облегающие колени, расширяющиеся кверху и заправляемые в сапоги). Qalife şalvar брюки галифе, qalife geyinmək носить галифе
Tam oxu »[fr. comite, əsli lat. committere – tapşırmaq] 1. Hər hansı bir işə rəhbərlik edən kollegial orqan. Partiya komitəsi
Tam oxu »...комитет, rayon icraiyyə komitəsi районный исполнительный комитет, yerli komitə местный комитет; yoxsullar komitələri истор. комитеты бедноты (организ
Tam oxu »i. committee; icraiyyə ~sı executive committee; Mərkəzi ~ Central Committee; partiya ~si Party Committee; Partiya nəzarəti ~sı Party Control Committee
Tam oxu »