
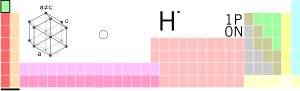




















...tibdə və biologiyada tətbiqi”. // Tərkibində hidrogen olan. Hidrogen birləşmələri. – Kimyəvi saf su iki kimyəvi ünsür əmələ gətirir. Bunlardan biri y
Tam oxu »...(химический элемент, легкий газ, образующий в соединении с кислородом воду). Hidrogen-peroksid перекись водорода II прил. 1. водородный (имеющий в св
Tam oxu »






















[yun. hydor və genos-doğma] водород (кислороддихъ галаз акахьдамаз яд арадал гъидай кьезил газ; химиядин элемент); // водороддин
Tam oxu »ру фторид водорода en hydrogen fluoride de Fluorwasserstoff fr hydrogène fluoré es hidrógeno fluorado it idrogeno fluorato
Tam oxu »ру газообразный водород en gaseous hydrogen de gasförmiger Wasserstoff fr hydrogène gazeux es hidrógeno gaseoso it idrogeno gassoso
Tam oxu »ру производство водорода en hydrogen generation de Wasserstofferzeugung fr génération d'hydrogène es generación de hidrógeno it generazione d'idrogeno
Tam oxu »ру сульфид свинца en lead sulfide de Bleisulfid fr sulfure de plomb es sulfuro de plomo it solfito di piombo
Tam oxu »ру сульфид меди en cupric sulfide de Kupfersulfid fr sulfure de cuivre es sulfuro de cobre it solfito di rame
Tam oxu »ру сульфид кадмия en cadmium sulfide de Kadmiumsulfid fr sulfure de cadmium es sulfuro de cadmio it solfito di cadmio
Tam oxu »хим. I сущ. сульфид; sulfidlər сульфиды (соединения серы с металлами и некоторыми неметаллами). Təbii sulfidlər природные сульфиды, üzvi sulfidlər орг
Tam oxu »мн. (ед. гидрид м) kim. hidridlər (hidrogenli metallar, metalların hidrogen birləşmələri).
Tam oxu »ру экстракция водорода en hydrogen extraction de Wasserstoffgewinnung fr extraction d'hydrogène es obtención de hidrógeno it estrazione d'idrogeno
Tam oxu »-ов; мн. (ед. - сульфид, -а; м.) (от лат. sulphur - сера); хим. см. тж. сульфидный Соединения серы с металлами и некоторыми неметаллами. Сульфиды тита
Tam oxu »мн. сульфидар (гургуртдинни жуьреба-жуьре элементрин акахьайбрув лугьудай умуми тIвар).
Tam oxu »хим. I сущ. сульфит; sulfitlər сульфиты (соли сернистой кислоты) II прил. сульфитный. Sulfit məhlulu сульфитный раствор, sulfit qatışıqları сульфитные
Tam oxu »прил. водородный (содержащий в себе водород). Hidrogenli birləşmələr водородные соединения
Tam oxu »[yun. hydor və phone – səs] Suda yayılan və ya əmələ gələn səs dalğalarını tutmaq üçün cihaz
Tam oxu »сущ. гидрофон (прибор для приема звуковых волн, распространяющихся или возникающих в воде)
Tam oxu »[yun. hydor və phone-səs] гидрофон (цин къене чкӀизвай ва я арадал къвезвай ванцин лепеяр кьун патал прибор)
Tam oxu »...oksigenlə doymuş, azad karbonat turşusu və hidrogen-sulfid isə tamamilə yoxdur.
Tam oxu »...(məs. bataqlıq, çürüntü, torpaq, kif, balıq, hidrogen sulfid, «çiçək» və s.); 2. antropogen mənşəli qoxular (məs. turşulu, mazut, neft məhsulları, mü
Tam oxu »...maddələrin parçalanan məhsulları SO2, metan, hidrogen-sulfid və digər avtoxton zəhərli (toksik) maddələrin konsentrasiyası yüksəlir.
Tam oxu »ж kinovar (1. qırmızı mineral (civə 2-sulfid); 2. kim. civə 2-sulfiddən alınan qırmızı rəng).
Tam oxu »прил. kim. selenid; tərkibində selen olan; селенистый водород hidrogen-selenid.
Tam oxu »molekuları yalnız karbon və hidrogen atomlarından ibarət olan üzvi birləşmələr sinfi.
Tam oxu »м kim. sianamid (hidrogen-sianamid turşusunun amid duzu: rəngsiz kristallik maddə).
Tam oxu »...мышьяк). Mərgmüşlü birləşmələr мышьяковистые соединения, mərgmüşlü hidrogen мышьяковистый водород
Tam oxu »i. explosion, burst; ~ etmək to set* off an explosion; atom (hidrogen) bombasının ~ı explosion of atom (hidrogen) bomb; vulkan ~ı volcanic explosion;
Tam oxu »...голубовато-серый металл, имеющий в спектре зелёные линии). Talium-sulfid сернистый таллий
Tam oxu »...физ., хим. атомарный (существующий в виде отдельных атомов). Atomar hidrogen атомарный водород
Tam oxu »...etil (bir çox üzvi birləşmələrin tərkibinə daxil olan karbon və hidrogen atomları qruplarından biri).
Tam oxu »