is. kim. oxyde m ; dəmir ~i oxyde ferrique ; azot ~i oxyde azotique

Oksid
Oksid — Biri oksigen olmaqla iki elementdən ibarət olan mürəkkəb maddələrə oksidlər deyilir. Oksidlərdə oksigenin oksidləşmə dərəcəsi "–2" olur. Yalnız Fe3O4 dəmirin qarışıq oksidində 8/3 valentlik göstərir ancaq başqa element atomları ilə birləşərkən. Məsələn: Na — O – Na. Oksigen atomlarının öz aralarında rabitə yaratdığı iki elementli mürəkkəb maddələr peroksidlər adlanır. Peroksidlərdə oksigenin oksidləşmə dərəcəsi "-1" olur. Məsələn: Na — O — O — Na — natrium peroksid; H — O — O — H — hidrogen peroksid. NaO2, KO2 superoksidləri və OF2 — birləşməsi oksid deyil. Hazırda He, Ne və Ar-dan başqa bütün elementlərin Oksigenli birləşmələri alınmışdır.
Kimyəvi xassələrinə görə oksidlər duzəmələgətirməyən və duzəmələgətirən oksidlərə bölünür.

Alüminium oksid
Alüminium oksid, Al2 O3 — alüminium və oksigenin kimyəvi birləşməsidir. Bir neçə alüminium oksid arasında ən çox rast gəlinən alüminium (III) oksid təyin edilmişdir. Ümumiyyətlə, alümina adlanır və ayrıca müəyyən forma və ya tətbiqlərə görə aloksid, aloksit və ya alundum da adlandırıla bilər. Təbii olaraq kristal polimorf fazasında α-Al2O3 mineral korund kimi meydana gəlir ki, bu da qiymətli daşlar yaqut və safirdir. Al2O3, sərtliyi sayəsində aşındırıcı və yüksək ərimə nöqtəsi sayəsində odadavamlı bir material olaraq alüminium metalının istehsalında əhəmiyyətlidir.
== Təbiətdə ==
Korund alüminium oksidin ən çox yayılmış təbii olaraq meydana gələn kristalformasıdır. Yaqut və sapfir korundun qiymətli keyfiyyətli formalarıdır. Yaqutlara xarakterik tünd qırmızı rəng və lazer keyfiyyəti xrom izləri ilə verilir. Safirlər dəmir və titan kimi fərqli rənglərdə olur. Son dərəcə nadir bir δ forması, deltalumit mineralı kimi meydana gəlir.
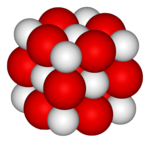
Kalsium-oksid
Əsasi oksiddir, turşu oksidləri və turşularla qarşılıqlı təsirdə olur.
1.CaO+CO2 → CaCO3
2.CaO+SO3 → CaSO4
3.CaO+H2SO4→ CaSO4+H2O
4.CaO+2HCl → CaCl2+H2O
Onu sənayedə əhəngdaşının parçalanmasından alırlar.
CaCO3→ CaO+CO2 ↑
CaO ağ rəngli, çətin əriyən (2570ºC temperaturda əriyir) maddədir. Onu su ilə reaksiyasından çoxlu istilik ayrılır. CaO-nun texniki adı “sönməmiş əhəng” olduğundan kalsium-oksidin su ilə qarşılıqlı təsirinə “əhəngin söndürülməsi” deyilir.
CaO+H2O→Ca(OH)2+Q
Kalsium –oksidin əsas etibarilə sönmüş əhəng Ca(OH)2, kalsium –karbid CaC2 almaq üçün istifadə edilir.

Sink oksid
Sink oksid ZnO (sinkit) - ağ rəngli qeyri-üzvi maddədir.
Suda həll olunmur, 1800 °C-ə qədər qızdırdıqda və sublimasiya zamanı saralır.
Altıbucaqlı, iysiz kristalik strukturu olan tozdur.
Sink hidroksidin parçalanması zamanı alınır:
Zn (OH)2→ ZnO + H2O (t=100-250°C).
Sinkin oksigenlə qarşılıqlı təsirindən alınır:
2Zn + О2 → 2ZnО
Həmçinin sink duzlarının parçalanması zamanı alınır.
Sink oksid amfoter oksidlərə aiddir. Turşularla reaksiya zamanı sink duzları alınır:
ZnO+2HCl→ZnCl2+H2O
Qələvilərlə reaksiya zamanı kaliun sinkat və su alınır:
ZnO+2KOH→K2ZnO2+H2O
ZnO + CoO → CoZnO2
Bor oksid və silisium dioksid ilə reaksiya zamanı şüşəyə oxşar boratlar və silikatlar alınır:
2ZnO + SiO2 → Zn2SiO4,
ZnO + B2O3 → Zn(BO2)2.
ZnO tibdə istifadə olunur.Sink oksidinin müasir tibbdə və kosmetologiyada geniş yayılması çoxfunksiyalılığı, geniş spektrli fəaliyyət və mükəmməl müalicəvi xüsusiyyətləri ilə əlaqədardır. Sink oksid tərkibli preparatlar yaxşı sakitləşdirici və müalicəvi xüsusiyyətlərə malikdir.
Toksikliyi
ZnO buxarı orqanizmə düşdükdə gözlərə və tənəffüs yollarına pis təsir edir, qıcıqlanma yarada bilər.

Dəmir (II) oksid
Dəmir (II) oksidi - dəmir (II) və oksigenin mürəkkəb qeyri-üzvi birləşməsidir. Təbiətdə vüstit mineralı kimi mövcuddur.
== Fiziki xassələri ==
Dəmir (II) oksid – qara rəngdə bərk birləşmədir. Yalnız yüksək temperaturda sabit vəziyyətdə olur.
== Alınması ==
Dəmir (III) oksidin hydrogen ilə reduksiyaedici reaksiyası zamanı almaq olar:
Fe2O3 + 3H2 → 2FeO + 3H2O
Dəmir (III) oksidin dəm qazı ilə reduksiyaedici reaksiyası zamanı:
Fe2O3 + CO → 2FeO + CO2
Dəmir(III) oksidin dəmir ilə reaksiyası zamanı:
Fe2O3 + Fe → 3FeO
Dəmirin oksigenlə aşağı təzyiq altında qızdırılması zamanı:
2Fe + O2 → 2FeO
Dəmir oksalatın vakuumda parçalanması zamanı:
FeC2O4 →t FeO + CO↑ + CO2↑
== Kimyəvi xassələri ==
Dəmir (II) oksid reaksiya zamanı əsası xassələr görsədir. Suda həll olunmur, oksidləşməyən turşularda asanlıqla həll olunur:
FeO + 2HCl → FeCl2 + H2O
Reduksiyaedici xassələr görsədir:
FeO + 4HNO3 → NO2 + Fe(NO3)3 + 2H2O
Dəmir(II) oksidin oksigenlə oksidləşmə reaksiyası:
4FeO + 3O2 → 2Fe2O3
Natriun hidroksidlə birgə əriməsı reaksiyası
FeO + 4NaOH →Na4FeO3 + 2H2O
Oksigenlə reaksiyası:
4FeO + 2nH2O + O2 → 2(Fe2O3 ⋅ nH2O)
6FeO + O2 →300−500 0C 2Fe3O4
Hidrogen sulfid ilə reaksiyası:
FeO + H2S →500 0C FeS + H2O
== Tətbiqi ==
Keramika və mineral boyaların tərkib hissəsi kimi istifadə olunur. E172 nömrəsi altında qida rəngi kimi qida sənayesində geniş istifadə olunur.
== Toksikliyi ==
Dəmir (II) oksidi zəhərli deyil. Buna baxmayaraq, dəmir (II) oksidin aerozollarına (toz, tüstü) uzun müddət məruz qaldıqdan sonra ağciyərlərdə çökür və pnevmokoniozun bir növü olan sideroza səbəb olur.
== Mənbə ==
Волков А. И., Жарский И. М. Большой химический справочник.

Germanium oksid (IV)
Germanium — oksidi (IV)
Germanium oksidi (IV) (germanium dioksid) germanium və oksigenin binar qeyri — üzvi kimyəvi birləşməsi olub amfoter oksiddir. Kimyəvi formulu GeO2 . Germanium – dioksidin forması silisium dioksidə çox oxşardır. İki kristallik və üçüncü amor modifikasiya halında mövcuddur :
Heksoqonal β- GeO2, α- kvars ilə eyni quruluşa malikdir.
Tetraqonal α- GeO2 (mineral forma argutit) SnO2 tipli struktura malikdir. Yüksək təzyiq altında CaCl2 tipli rombik formaya keçir.
Amorf GeO2 şüşəvari kvarsa bənzəyir, suda həll olandır.
Tetraqonal germanium dioksid 1033 °C -də heksoqonal formaya keçir. ∆Hα→ β=21,6kC/mol
== Alınması ==
Germanium dioksidi GeCl4 hidrolizə uğradıb, alınan çöküntünün 900°C-də qurutmaqla alınır. Bu zaman adətən amorf və heksoqonal GeO2 qarışığı alınır.

Manqan (III) oksid
Manqan (III) oksid — suda həll olmayan qeyri üzvi birləşmədir.
== Fiziki xassələri ==
Manqan (III) oksidi bir neçə modifikasiyada qəhvəyi-qara kristallar əmələ gətirir:
α-Mn2O3, rombik sinqoniya, kurnakit mineralı
β-Mn2O3, kuboid sinqoniya, mineral biksbiit
γ-Mn2O3, tetragonal sinongiya
== Alınması ==
Təbiətdə braunit, kurnakit və biksbiit mineralı kimi mövcuddur.
Manqan (III) oksidini oksidləşdirici-reduksiyaedici reaksiya zamanı almaq olar:
2 MnO 2 + Zn → Mn 2O3 + ZnO
Manqan(II) oksidin oksidləşməsi zamanı alınır:
4 MnO + O2 → 2 Mn2O3
Manqan(IV) oksidin reduksiyaedici reaksiyası zamanı alınır:
2 MnO2 + H2 → Mn2O3 + H2O
== Kimyəvi xassələri ==
Manqan (III) oksidi qızdırıldıqda parçalanır:
6
M
n
2
O
3
→
950
−
1100
o
C
4
M
n
3
O
4
+
O
2
{\displaystyle {\mathsf {6Mn_{2}O_{3}\ {\xrightarrow {950-1100^{o}C}}\ 4Mn_{3}O_{4}+O_{2}}}}
6
M
n
2
O
3
→
300
−
600
o
C
,
v
a
c
u
u
m
4
M
n
3
O
4
+
O
2
{\displaystyle {\mathsf {6Mn_{2}O_{3}\ {\xrightarrow {300-600^{o}C,vacuum}}\ 4Mn_{3}O_{4}+O_{2}}}}
Hidrogenlə reduksiya edilir:
M
n
2
O
3
+
H
2
→
300
o
C
2
M
n
O
+
H
2
O
{\displaystyle {\mathsf {Mn_{2}O_{3}+H_{2}\ {\xrightarrow {300^{o}C}}\ 2MnO+H_{2}O}}}
M
n
2
O
3
+
2
A
l
I
3
→
2
M
n
I
2
+
A
l
2
O
3
+
I
2
↑
{\displaystyle {\mathsf {Mn_{2}O_{3}+2AlI_{3}\ {\xrightarrow {}}\ 2MnI_{2}+Al_{2}O_{3}+I_{2}\uparrow }}}
ub>O
Turşularla reaksiya zamanı həm oksidləşdirici həm də reduksiyaedici xasissə göstərir:
2Mn2O3 + 8HNO3 → 4Mn(NO3)2 + O2 + 4H2O
2M2О3 + H2SO4 → MnSO4 + MnO2↓+ 2H2O
Metal oksidləri ilə əridildikdə, manqanit duzları əmələ gətirir:
Mn2O3 + ZnO → Zn[Mn2O4]
Mn2O3 + La2O3 → 2 La[MnO3]
Konsentrləşdirilmiş xlor turşusu ilə oksidləşdirici xüsusiyyətlərini göstərir:
Mn2O3+ 6HCl → 2MnCl2 + Cl2↑ + 3H2O
== Mənbə ==
Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
Неорганическая химия / под ред. Ю.Д. Третьякова. — М.: Академия, 2007.

Mis (II)oksid
Mis (II) oksidi (mis oksidi) CuO – iki valentli mis oksididir. Qara kristaldır, normal şəraitdə olduqca sabitdir, suda həll olunmur. Təbiətdə tenorit (melakonit) mineralı kimi mövcuddur.
Mis (II) oksidi havada metalik misi qızdırmaqla (1100 ° C-dən aşağı olan temperaturda) almaq olar:
2Cu + O2 = 2СuО
Mis (II) hidroksidi, onun nitrat və ya karbonatını qızdırmaqla mis (II) oksidi almaq olar:
2Cu(NO3)2 → 2CuO + 4NO2 + O2
CuCO3 → CuO + CO2
Cu(OH)2 → CuO + H2O
Malaxiti qızdırmaqla CuO alınır:
Cu2CO3(OH)2 →2CuO + CO2 + H2O
Mis (II) oksid turşularla reaksiyaya qirərək mis (II) duzları və su əmələ qətirir:
CuO + 2HNO3 → Cu(NO3)2 + H2O
CuO qələvilərlə qarşılıqlı əritməklə kupratlar alınır:
CuO + 2KOH → K2CuO2 + H2O
11000C qədər qızdırılıqda mis və oksigen alınır. Mis (II) oksidə yaxın qələn mis (II) hidroksid zəif qələvidir. Qələvilərin qatı məhlulu ilə reaksiya zamanı hidrokso-kupratlar əmələ gəlir.
Cu(OH)2 + 2NaOH → Na2 [Cu(OH)2]
Mis (II) oksidi monoklin kristal sisteminə aiddir.
CuO, yaşıl və mavi rəng vermək üçün şüşə istehsalında istifadə olunur. Bundan əlavə, mis oksid mis — yaqut şüşələrin istehsalında istifadə olunur. Mis(II) oksidi quru batareyalar hazırlamaq üçün istifadə edilə bilər.

Qalay 4-oksid
Kassiterit və ya qalay 4-oksid (SnO2) — dördvalentli qalayın oksigenli birləşməsi.Qalay 4-oksid suda həll olmur, təbiətdə kassiterit mineralı şəklində tapılır, turşu və qələvi məhlullarının təsirinə qarşı müstəsna dərəcədə davamlıdır, karbon, hidroken və s. ilə asan reduksiya olunur. Sənayedə qalayı oksigendə yandırmaqla alınır. İstiyədavamlı minalar və qurğuşun-qalay şirləri hazırlanmasında işlədilir.

Renium VI oksid
Renium (VI) oksid ReO3 – qeyri-üzvi birləşmədir. Suda həll olmayan tünd-qırmızı kristallardır
Renim (VI) oksid kub sistemin tünd qırmızı paramaqnit kristallarını, fəza qrupu Pm3m, hüceyrə parametrləri a = 0.3734 nm,
Z = 1 əmələ gətirir.
Renium (VII) oksidin kommutasiya reaksiyası nəticəsində alınır:
3
R
e
2
O
7
+
R
e
→
250
−
300
o
C
,
N
2
7
R
e
O
3
{\displaystyle {\mathsf {3Re_{2}O_{7}+Re\ {\xrightarrow {250-300^{o}C,N_{2}}}\ 7ReO_{3}}}}
R
e
2
O
7
+
R
e
O
2
→
145
o
C
,
N
2
3
R
e
O
3
{\displaystyle {\mathsf {Re_{2}O_{7}+ReO_{2}\ {\xrightarrow {145^{o}C,N_{2}}}\ 3ReO_{3}}}}
Renium (VII) oksidin karbonmonooksidlə reduksiya nəticəsində:
R
e
2
O
7
+
C
O
→
T
o
C
2
R
e
O
3
+
C
O
2
{\displaystyle {\mathsf {Re_{2}O_{7}+CO\ {\xrightarrow {T^{o}C}}\ 2ReO_{3}+CO_{2}}}}
Renim (VI) oksid qızdırdıqda parçalanır:
3
R
e
O
3
→
300
o
C
,
v
a
c
u
u
m
R
e
O
2
+
R
e
2
O
7
{\displaystyle {\mathsf {3ReO_{3}\ {\xrightarrow {300^{o}C,vacuum}}\ ReO_{2}+Re_{2}O_{7}}}}
8
R
e
O
3
→
400
o
C
,
v
a
c
u
u
m
4
R
e
O
2
+
2
R
e
2
O
7
+
O
2
{\displaystyle {\mathsf {8ReO_{3}\ {\xrightarrow {400^{o}C,vacuum}}\ 4ReO_{2}+2Re_{2}O_{7}+O_{2}}}}
Qatı azot turşusu ilə oksidləşir:
R
e
O
3
+
H
N
O
3
→
H
R
e
O
4
+
N
O
2
↑
{\displaystyle {\mathsf {ReO_{3}+HNO_{3}\ {\xrightarrow {}}\ HReO_{4}+NO_{2}\uparrow }}}
Hava ilə təmasda olduqda oksidləşir:
4
R
e
O
3
+
O
2
→
160
−
400
o
C
2
R
e
2
O
7
{\displaystyle {\mathsf {4ReO_{3}+O_{2}\ {\xrightarrow {160-400^{o}C}}\ 2Re_{2}O_{7}}}}
Oksidləşdirici m::
2
R
e
O
3
+
H
2
O
2
→
2
H
R
e
O
4
{\displaystyle {\mathsf {2ReO_{3}+H_{2}O_{2}\ {\xrightarrow {}}\ 2HReO_{4}}}}
addələrin məhlulları ilə reaksiyaya daxil olduqda (azot turşusu, hidrogen peroksid, bromlu su və s.) renium turşusu alınır:
Hidrogenlə reduksiya olunur:
R
e
O
3
+
3
H
2
→
450
−
800
o
C
R
e
+
3
H
2
O
{\displaystyle {\mathsf {ReO_{3}+3H_{2}\ {\xrightarrow {450-800^{o}C}}\ Re+3H_{2}O}}}
Renium oksidləri katalizator kimi üzvi və qeyri-üzvi sintezdə istifadə olunur. Həm də metalurqiyada materialın fiziki və kimyəvi xüsusiyyətlərini yaxşılaşdıran bir komponent kimi istifadə olunur.
Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
Справочник химика / Редкол.: Никольский Б.П. и др..

Rutenium (VIII)oksid
Rutenium (VIII) oksid – formulu RuO4 olan qeyri-üzvi birləşmədir.
Rutenium (VIII) oksid ilk dəfə Karl Klaus tərəfindən 1860-cı ildə kəşf edilmişdir.
Rutenum (VIII) oksid sarı-narıncı kristallar əmələ gətirir.
Rutenium tetraoksid uçucu birləşmədir və asanlıqla sublimasiya olur.
100 ° C-dən çox qızdırıldıqda, partlayışla parçalanır. Güclü oksidləşdirici maddədir, ozon qoxusu verir, spirt ilə reaksiyaya daxil olduqda partlayış baş verir.
Suda orta dərəcədə həll olunur, sulu məhlulları zəif bir turşudur pK1 =11.0.
Rutenium qızdırıldıqda oksigenlə oksidləşir:
R
u
+
2
O
2
→
1000
o
C
R
u
O
4
{\displaystyle {\mathsf {Ru+2O_{2}\ {\xrightarrow {1000^{o}C}}\ RuO_{4}}}}
Ruteniumun kalium bromat ilə oksidləşməsi nəticəsində:
5
R
u
+
8
K
B
r
O
3
+
4
H
2
S
O
4
→
80
o
C
5
R
u
O
4
+
4
B
r
2
+
4
K
2
S
O
4
+
4
H
2
O
{\displaystyle {\mathsf {5Ru+8KBrO_{3}+4H_{2}SO_{4}\ {\xrightarrow {80^{o}C}}\ 5RuO_{4}+4Br_{2}+4K_{2}SO_{4}+4H_{2}O}}}
Rutenium(IV) oksidi qızdırılaraq parçalanması nəticəsində:
R
u
O
2
+
O
2
→
700
−
1400
o
C
R
u
O
4
{\displaystyle {\mathsf {RuO_{2}+O_{2}\ {\xrightarrow {700-1400^{o}C}}\ RuO_{4}}}}
Kalium tetroksarutenatın (VI) xlor ilə oksidləşməsindən:
2
R
u
O
2
→
1300
o
C
R
u
+
R
u
O
4
{\displaystyle {\mathsf {2RuO_{2}\ {\xrightarrow {1300^{o}C}}\ Ru+RuO_{4}}}}
K
2
R
u
O
4
+
C
l
2
→
R
u
O
4
↓
+
2
K
C
l
{\displaystyle {\mathsf {K_{2}RuO_{4}+Cl_{2}\ {\xrightarrow {}}\ RuO_{4}\downarrow +2KCl}}}
Rutenum (VIII) oksid qızdırıldıqda parçalanır:
R
u
O
4
→
100
o
C
R
u
O
2
+
O
2
↑
{\displaystyle {\mathsf {RuO_{4}\ {\xrightarrow {100^{o}C}}\ RuO_{2}+O_{2}\uparrow }}}
Güclü oksidləşdiricidi. Xlorid turşusunun durulaşmış məhlulu ilə reaksiyaya daxil olur:
R
u
O
4
+
10
H
C
l
→
H
2
[
R
u
C
l
6
]
+
2
C
l
2
↑
+
4
H
2
O
{\displaystyle {\mathsf {RuO_{4}+10HCl\ \xrightarrow {} \ H_{2}[RuCl_{6}]+2Cl_{2}\uparrow +4H_{2}O}}}
4
R
u
O
4
+
32
H
C
l
→
2
(
R
u
C
l
3
⋅
R
u
C
l
4
]
↓
+
9
C
l
2
↑
+
16
H
2
O
{\displaystyle {\mathsf {4RuO_{4}+32HCl\ {\xrightarrow {}}\ 2(RuCl_{3}\cdot RuCl_{4}]\downarrow +9Cl_{2}\uparrow +16H_{2}O}}}
Qələvilərlə reaksiyaya daxil olur:
4
R
u
O
4
+
4
K
O
H
→
4
K
R
u
O
4
↓
+
O
2
↑
+
2
H
2
O
{\displaystyle {\mathsf {4RuO_{4}+4KOH\ {\xrightarrow {}}\ 4KRuO_{4}\downarrow +O_{2}\uparrow +2H_{2}O}}}
2
R
u
O
4
+
4
K
O
H
→
100
o
C
2
K
2
R
u
O
4
+
O
2
↑
+
2
H
2
O
{\displaystyle {\mathsf {2RuO_{4}+4KOH\ {\xrightarrow {100^{o}C}}\ 2K_{2}RuO_{4}+O_{2}\uparrow +2H_{2}O}}}
2
R
u
O
4
+
2
H
2
O
2
→
100
o
C
2
R
u
O
2
↓
+
3
O
2
↑
+
2
H
2
O
{\displaystyle {\mathsf {2RuO_{4}+2H_{2}O_{2}\ {\xrightarrow {100^{o}C}}\ 2RuO_{2}\downarrow +3O_{2}\uparrow +2H_{2}O}}}
Rutenium tetroksid çox zəhərli, uçucu, güclü oksidləşdirici maddədir, buna görə möhürlənmiş ampulalarda saxlanmalıdır.
Справочник химика / Редкол.: Никольский Б.П. и др..

Xrom(VI)oksid
Xrom(VI)oksid (xrom anhidridi) CrO3 — oksigenli, tünd qırmızı kristalları olan, suda asanlıqla həll olan xrom birləşməsidir. Xrom və dixromat turşusu anhidrididir.
Xrom(VI)oksid –bənövşəyi rəngə çalan qara-qırmızı rəngli kristallardı. Hiqroskopikdi, havada yayılır. Atmosfer təzyiqində qaynamatemperaturundan aşağı parçalanır. Suda həll
olması — 166 г/100 г (15 °C), 199 г/100 г (100 °C).
Xrom(VI)oksidini, sulfat turşusunu natrium dixromata təsirindən (kalium dixromata az hallarda) almaq olar:
N
a
2
C
r
2
O
7
+
H
2
S
O
4
→
2
C
r
O
3
+
N
a
2
S
O
4
+
H
2
O
{\displaystyle {\mathsf {Na_{2}Cr_{2}O_{7}+H_{2}SO_{4}\rightarrow 2CrO_{3}+Na_{2}SO_{4}+H_{2}O}}}
CrO3 turşu oksiddir. Suda həll edildikdə, xrom turşusu əmələ gəlir (CrO3 az olanda)
C
r
O
3
+
H
2
O
→
H
2
C
r
O
4
{\displaystyle {\mathsf {CrO_{3}+H_{2}O\rightarrow H_{2}CrO_{4}}}}
və ya dixromat turşusu (CrO3 çox olanda)
2
C
r
O
3
+
H
2
O
→
H
2
C
r
2
O
7
{\displaystyle {\mathsf {2CrO_{3}+H_{2}O\rightarrow H_{2}Cr_{2}O_{7}}}}
Qələvi məhlulları ilə reaksiyaya girdikdə xromatlar alınır:
C
r
O
3
+
2
K
O
H
→
K
2
C
r
O
4
+
H
2
O
{\displaystyle {\mathsf {CrO_{3}+2KOH\rightarrow K_{2}CrO_{4}+H_{2}O}}}
250 °C-dən yuxarı qızdırıldıqda parçalanır və nəticədə xrom(III)oksid və oksigen alınır:
4
C
r
O
3
→
2
C
r
2
O
3
+
3
O
2
{\displaystyle {\mathsf {4CrO_{3}\rightarrow 2Cr_{2}O_{3}+3O_{2}}}}
Bütün Cr (VI) birləşmələri kimi, CrO3 də güclü oksidləşdirici vasitədir (Cr2O3 -ə qədər reduksiya olunur). Məsələn, etanol, aseton və bir çox digər üzvi maddələr toz halına gətirildiqdən sonra xrom VI oksidi ilə təmasda olduqda öz — özünə alovlanır və ya hətta partlayır (bəzi istinad kitablarında "spirtdə və efirdə həll olunur" göstərilsə də). Yaxşı üyüdülməsə xrom anhidridi kristalları ilə təmasda olduqda spirtlərin və ketonların alovlanmasına nail olmaq mümkün deyil.

Xrom (II) oksid
İki polimorf formada mövcuddur. Qırmızı (pirofor deyil) və qara pirofor toz (havada öz-özünə alovlanan) buna görə də qara modifikasiya su qatının altında saxlanılır (su ilə qarşılıqlı təsir göstərmir). Altıbucaqlı kristalları əmələ gətirir. Bütün xrom oksidləri kimi odadavamlıdır. Suda həll olunmur.
Azot turşusu və ya oksigen ilə xrom amalgamasının CrHg3 və ya CrHg oksidləşməsi nəticəsində əldə edilir:
2
C
r
H
g
3
+
O
2
→
2
C
r
O
+
6
H
g
{\displaystyle {\mathsf {2CrHg_{3}+O_{2}\rightarrow 2CrO+6Hg}}}
Xrom ııı oksidin reduksiya nəticəsində:
H
3
P
O
2
+
2
C
r
2
O
3
→
4
C
r
O
+
H
3
P
O
4
{\displaystyle {\mathsf {H_{3}PO_{2}+2Cr_{2}O_{3}\rightarrow 4CrO+H_{3}PO_{4}}}}
Cr (CO)6 karbonilin termiki parçalanması ilə də əldə edilə bilər.
1. 697 °C temperaturda parçalanır:
3
C
r
O
→
C
r
2
O
3
+
C
r
{\displaystyle {\mathsf {3CrO\rightarrow Cr_{2}O_{3}+Cr}}}
2. 1000 °C -də hidrogenlə xrom metalına gədər reduksiya edilir:
::
C
r
O
+
H
2
→
1000
o
C
C
r
+
H
2
O
{\displaystyle {\mathsf {CrO+H_{2}{\xrightarrow {1000^{o}C}}Cr+H_{2}O}}}
3. Həmçinin koksla reduksiya etmək olar:
C
r
O
+
C
→
t
C
r
+
C
O
{\displaystyle {\mathsf {CrO+C{\xrightarrow {t}}Cr+CO}}}
4. Əsası xassələr görsədərək xlorid turşusunda həll olunur, nəticədə su və xrom II xlor alınır:
C
r
O
+
2
H
C
l
→
C
r
C
l
2
+
H
2
O
{\displaystyle {\mathsf {CrO+2HCl\rightarrow CrCl_{2}+H_{2}O}}}
Durulaşdırılmış azot və sulfat turşusunda həll olunmur.
Havada qızdırıldıqda güclü reduksiyaedici xüsusiyyətlərini nümayiş etdirərək xrom (III) oksidinə gədər sürətlə oksidləşir.
2
C
r
O
+
C
O
2
→
1000
o
C
C
r
2
O
3
+
C
O
{\displaystyle {\mathsf {2CrO+CO_{2}\ {\xrightarrow {1000^{o}C}}\ Cr_{2}O_{3}+CO}}}
6 -dan az valentliyi olan xrom birləşmələri aşağı toksikliyə malikdir. 6+ valentliyi olan xrom birləşmələri (xrom (VI) oksid) təhlükəli zəhərlər və kanserogenlər kimi tanınır.
Некрасов Б.В. Основы общей химии.

İndium (III) oksid
Indium (III) oksid (İn2O3) – ikili qeyri-üzvibirləşmədir.
İndium(III)oksid amorf maddədir və ya açıq sarı kristallardır (qızdırdıqda qırmızı-qəhvəyi),kubik sinqoniyanın kristallarını əmələ gətirir, fəza qrupu a3, hüceyrə parametrləri a = 1,01194 nm, Z = 16. 6,5 GPa təzyiqdə və 300 -400 °C temperaturda altıbucaqlı qəfəsli fazaya keçir, normal şəraitdə sabitdir. Kristallar R 3c fəza qrupuna aiddir, hüceyrə parametrləri a = 0,5487 nm, c = 1,4510 nm, Z = 6, sıxlıq 7,3 q / sm³.
Oksigenin yüksək təzyiqindən 1910 °C-də əriyir və normal şəraitdə 850 °C-də asanlıqla buxar halına keçir və parçalanmağa başlayır.
1. Qızdırıldıqda indium bənövşəyi alovla yanır:
4
I
n
+
3
O
2
→
>
800
o
C
2
I
n
2
O
3
{\displaystyle {\mathsf {4In+3O_{2}\ {\xrightarrow {>800^{o}C}}\ 2In_{2}O_{3}}}}
2. İndium hidroksidinin termiki parçalanması nəticəsində:
2
I
n
(
O
H
)
3
→
350
o
C
I
n
2
O
3
+
3
H
2
O
{\displaystyle {\mathsf {2In(OH)_{3}\ {\xrightarrow {350^{o}C}}\ In_{2}O_{3}+3H_{2}O}}}
3. İndium nitratın, indium sulfatın parçalanması nəticəsində:
4
I
n
(
N
O
3
)
3
→
230
o
C
2
I
n
2
O
3
+
12
N
O
2
+
3
O
2
{\displaystyle {\mathsf {4In(NO_{3})_{3}\ {\xrightarrow {230^{o}C}}\ 2In_{2}O_{3}+12NO_{2}+3O_{2}}}}
4. İndium sulfidin oksidləşmə nəticəsində almaq olar:
2
I
n
2
S
3
+
9
O
2
→
650
o
C
2
I
n
2
O
3
+
6
S
O
2
{\displaystyle {\mathsf {2In_{2}S_{3}+9O_{2}\ {\xrightarrow {650^{o}C}}\ 2In_{2}O_{3}+6SO_{2}}}}
1. Qızdırıldıqda parçalanaraq buxarlanır:
I
n
2
O
3
←
→
1000
o
C
I
n
2
O
+
O
2
{\displaystyle {\mathsf {In_{2}O_{3}\ {\stackrel {\xrightarrow {1000^{o}C}}{\xleftarrow[{\ \ \ \ \ \ }]{}}}\ In_{2}O+O_{2}}}}
2. Qatı turşularla reaksiyaya daxil olur:
I
n
2
O
3
+
6
H
C
l
→
2
I
n
C
l
3
+
3
H
2
O
{\displaystyle {\mathsf {In_{2}O_{3}+6HCl\ {\xrightarrow {}}\ 2InCl_{3}+3H_{2}O}}}
3. Hidrogenlə metala gədər reduksiya olunur:
I
n
2
O
3
+
3
H
2
→
700
o
C
2
I
n
+
3
H
2
O
{\displaystyle {\mathsf {In_{2}O_{3}+3H_{2}\ {\xrightarrow {700^{o}C}}\ 2In+3H_{2}O}}}
4. Hidrogen sulfidlə reaksiyaya daxil olur:
I
n
2
O
3
+
3
H
2
S
→
500
o
C
I
n
2
S
3
+
3
H
2
O
{\displaystyle {\mathsf {In_{2}O_{3}+3H_{2}S\ {\xrightarrow {500^{o}C}}\ In_{2}S_{3}+3H_{2}O}}}
İndium(III)oksid yarımkeçirici material kimi istifadə olunur. Həmçinin xüsusi şüşələrin komponenti, neytron adsorbentləri kimi tətbiq olunur.
Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов.

Neodim III oksid
Neodim oksid (Nd2O3) neodim əlvan metalının havada qızdırılması yolu ilə əldə edilir ki, həmin hava bunun hesabına çox tez qızır və qeyri-metallarla – azot, halogenlər, kükürd, hidrogen və digərləri ilə reaksiyaya daxil olur.
Xarici görünüşü – mavi, refrakter toz.
Elementin bütün tərkib hissələrindən ən çox onun oksidi əhəmiyyət kəsb edir, hansı ki bir sıra fiziki-kimyəvi xüsusiyyətli üstünlüklərə malikdir:
-ərimə temperaturu – 2200° C;
-qaynama temperaturu – 3300° C;
-suda və orta güclü mineral turşularda həll olunur;
-asan higroskopik material;
-soyuq su, alkalilər və ammonium hidratla reaksiyaya daxil olmur.
Onun təmizliyi 99%, 99,9%, 99,99%, 99,999% təşkil edir.
Neodim oksidin yaxşı xüsusiyyətlərinə görə, tətbiq sahəsi kifayət qədər genişdir. Hər şeydən çox keramika və şüşəəritmədə istifadə olunur. Neodim şüşəsi onun şüşə ərintilərinə daxil edilməsi yolu ilə əldə edilir. Belə şüşələr lazer və kosmik cihazlarda, yarımkeçirici lazerlərdə və inertial termoatom sintezi üçün multişüa sistemlərində istifadə olunur.
Neodim oksid dielektrik olaraq çox az genişlənmə əmsalı ilə istifadə olunur.
Onun istifadəsinə hətta gündəlik həyatda da rast gəlmək olar.

Azot-1 oksid
Azot-1 oksid duz əmələ gətirməyən oksiddir
== Tarixi ==
Diazot-monoksid və ya azot 1-oksid (N2O) ilk dəfə 1772-ci ildə Cozef Pristli tərəfindən alınmışdır və onu azaldılmış azot havası adlandırmışdır. Texniki adı şadlandırıcı-şənləndirici qazdır. Bu da onun keyləşdirici xüsusiyyətə malik olması ilə əlaqədardır. Tərkibində N2O olan hava ilə tənəffüs etdikdə əvvəlcə oyadıcı təsir göstərir, sonra isə keyləşmə baş verir. N2O-nun keyləşdirici təsirini ilk dəfə 1799-cu ildə məşhur ingilis alimi H. Devi müəyyən etmişdir. Belə ki, N2O qarışmış hava ilə tənəffüs etdikdə diş ağrısı aradan qalxır. Devinin bununla bağlı bir çox maraqlı təcrübələri var. Bundan yarım əsr sonra 1844-cü ildə amerikalı diş həkimi X. Uells dişlərin çıxarılmasında N2O- dan ağrıkəsici vasitə kimi istifadə etmişdir. Hazırda diazot-oksidindən miokard (ürəyin əzələ qişası) infarktının əməliyatında ağrıkəsici kimi (80% N2 və 20% O2) istifadə edilir.
== Xassələri ==
N2O rəngsiz, xoşagələn zəif iyli, şirintəhər qazdır.

Bismut oksid(II)
Bismut oksid(II)
Bismut monooksid – BiO formullu bismut metalı və oksigenin binar qeyri- üzvi birləşməsidir. Boz-qara rəngli kristallardır. Soyuq su ilə qarşılıqlı təsirdə olub, kristallohidrat əmələ gətirir. Ərimə temperaturu 902 °C, qaynama 1647 °C.
== Alınması ==
Bismut 3-oksidi bismutla qarşılıqlı təsirindən
B
i
2
O
3
+
B
→
3
B
i
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+B\rightarrow 3BiO}}}
Hidrogen ilə 265℃ temperaturda
B
i
2
O
3
+
H
2
→
2
B
i
O
+
H
2
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+H_{2}\rightarrow 2BiO+H_{2}O}}}
Karbon oksidi ilə 400℃ temperaturda
B
i
2
O
3
+
C
O
→
2
B
i
O
+
C
O
2
{\displaystyle {\mathsf {Bi_{2}O_{3}+CO\rightarrow 2BiO+CO_{2}}}}
== Kimyəvi xassələri ==
Havada qızdırıdıqda oksidləşir 180℃ temperaturda
4
B
i
O
+
O
2
→
2
B
i
2
O
3
{\displaystyle {\mathsf {4BiO+O_{2}\rightarrow 2Bi_{2}O_{3}}}}
Metala qədər
300℃ temperaturda
B
i
O
+
H
2
→
2
B
i
+
H
2
O
{\displaystyle {\mathsf {BiO+H_{2}\rightarrow 2Bi+H_{2}O}}}
250℃ temperaturda
B
i
O
+
C
O
→
2
B
i
+
C
O
2
{\displaystyle {\mathsf {BiO+CO\rightarrow 2Bi+CO_{2}}}}
Turşularla turşu oksidləri ilə qarşılıqlı təsirdə olur.
3
B
i
O
+
6
H
C
l
→
2
B
i
C
l
3
+
B
i
+
3
H
2
O
{\displaystyle {\mathsf {3BiO+6HCl\rightarrow 2BiCl_{3}+Bi+3H_{2}O}}}
5
B
i
O
+
C
O
2
→
2
B
i
2
O
3
+
B
i
+
C
O
{\displaystyle {\mathsf {5BiO+CO_{2}\rightarrow 2Bi_{2}O_{3}+Bi+CO}}}
== Ədəbiyyat ==
Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
Справочник химика / Редкол.: Никольский Б. П. и др.. — 2-е изд., испр.

Bismut oksid(III)
Bismut oksid(III)
Bismut oksid(III) – bismut metalı və oksigenin binar qeyri-üzvi birləşməsidir. Formulu Bi2O3 . Suda həll olmayan sarımtıl kristallardır.
== Alınması ==
Təbiətdə bismit mineralına rast gəlinir- Bi2O3 bismut oksidi.
Bismutun havada yanması ilə (500–1000℃)
4
B
i
+
3
O
2
→
2
B
i
2
O
3
{\displaystyle {\mathsf {4Bi+3O_{2}\rightarrow 2Bi_{2}O_{3}}}}
•Bismut nitratın parçalanmasından (700℃)
4
B
i
(
N
O
3
)
3
→
2
B
i
2
O
3
+
12
N
O
2
+
3
O
2
{\displaystyle {\mathsf {4Bi(NO_{3})_{3}\rightarrow 2Bi_{2}O_{3}+12NO_{2}+3O_{2}}}}
•Bismut sulfidin oksidləşməsindən(400℃)
2
B
i
2
S
3
+
9
O
2
→
2
B
i
2
O
3
+
6
S
O
2
{\displaystyle {\mathsf {2Bi_{2}S_{3}+9O_{2}\rightarrow 2Bi_{2}O_{3}+6SO_{2}}}}
== Fiziki xassələri ==
Bismut oksidi (III) ağ-sarımtıl kristallardır. Dörd kristallik modifikasiyası var:
alfa — Bi2O3 monoklin sinqoniya (psevdorombik), havada 727 °C qızdırdıqda oksigeni itirir və omeqa — Bi2O3-x keçir.
beta — Bi2O3, parlaq sarı kristal, tetraqonal sinqoniya 646 °C qədər soyudulduqda omeqa — Bi2O3- dən əmələ gəlir, 620–605°C-də alfa- Bi2O3 keçir.
qamma — Bi2O3 parlaq sarı kristaldır, kubşəkilli sinqoniyaya malikdir.
siqma — Bi2O3, narıncı kristallardır, kubşəkilli sinqoniyaya malikidir.
== Kimyəvi xassələri ==
qatı, isti turşularla reaksiyaya girir.(70–80℃)
B
i
2
O
3
+
6
H
C
l
→
2
B
i
C
l
3
+
3
H
2
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+6HCl\rightarrow 2BiCl_{3}+3H_{2}O}}}
xlorla reaksiyaya girir.

Bismut oksid (II)
Bismut oksid(II)
Bismut monooksid – BiO formullu bismut metalı və oksigenin binar qeyri- üzvi birləşməsidir. Boz-qara rəngli kristallardır. Soyuq su ilə qarşılıqlı təsirdə olub, kristallohidrat əmələ gətirir. Ərimə temperaturu 902 °C, qaynama 1647 °C.
== Alınması ==
Bismut 3-oksidi bismutla qarşılıqlı təsirindən
B
i
2
O
3
+
B
→
3
B
i
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+B\rightarrow 3BiO}}}
Hidrogen ilə 265℃ temperaturda
B
i
2
O
3
+
H
2
→
2
B
i
O
+
H
2
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+H_{2}\rightarrow 2BiO+H_{2}O}}}
Karbon oksidi ilə 400℃ temperaturda
B
i
2
O
3
+
C
O
→
2
B
i
O
+
C
O
2
{\displaystyle {\mathsf {Bi_{2}O_{3}+CO\rightarrow 2BiO+CO_{2}}}}
== Kimyəvi xassələri ==
Havada qızdırıdıqda oksidləşir 180℃ temperaturda
4
B
i
O
+
O
2
→
2
B
i
2
O
3
{\displaystyle {\mathsf {4BiO+O_{2}\rightarrow 2Bi_{2}O_{3}}}}
Metala qədər
300℃ temperaturda
B
i
O
+
H
2
→
2
B
i
+
H
2
O
{\displaystyle {\mathsf {BiO+H_{2}\rightarrow 2Bi+H_{2}O}}}
250℃ temperaturda
B
i
O
+
C
O
→
2
B
i
+
C
O
2
{\displaystyle {\mathsf {BiO+CO\rightarrow 2Bi+CO_{2}}}}
Turşularla turşu oksidləri ilə qarşılıqlı təsirdə olur.
3
B
i
O
+
6
H
C
l
→
2
B
i
C
l
3
+
B
i
+
3
H
2
O
{\displaystyle {\mathsf {3BiO+6HCl\rightarrow 2BiCl_{3}+Bi+3H_{2}O}}}
5
B
i
O
+
C
O
2
→
2
B
i
2
O
3
+
B
i
+
C
O
{\displaystyle {\mathsf {5BiO+CO_{2}\rightarrow 2Bi_{2}O_{3}+Bi+CO}}}
== Ədəbiyyat ==
Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
Справочник химика / Редкол.: Никольский Б. П. и др.. — 2-е изд., испр.

Bismut oksid (III)
Bismut oksid(III)
Bismut oksid(III) – bismut metalı və oksigenin binar qeyri-üzvi birləşməsidir. Formulu Bi2O3 . Suda həll olmayan sarımtıl kristallardır.
== Alınması ==
Təbiətdə bismit mineralına rast gəlinir- Bi2O3 bismut oksidi.
Bismutun havada yanması ilə (500–1000℃)
4
B
i
+
3
O
2
→
2
B
i
2
O
3
{\displaystyle {\mathsf {4Bi+3O_{2}\rightarrow 2Bi_{2}O_{3}}}}
•Bismut nitratın parçalanmasından (700℃)
4
B
i
(
N
O
3
)
3
→
2
B
i
2
O
3
+
12
N
O
2
+
3
O
2
{\displaystyle {\mathsf {4Bi(NO_{3})_{3}\rightarrow 2Bi_{2}O_{3}+12NO_{2}+3O_{2}}}}
•Bismut sulfidin oksidləşməsindən(400℃)
2
B
i
2
S
3
+
9
O
2
→
2
B
i
2
O
3
+
6
S
O
2
{\displaystyle {\mathsf {2Bi_{2}S_{3}+9O_{2}\rightarrow 2Bi_{2}O_{3}+6SO_{2}}}}
== Fiziki xassələri ==
Bismut oksidi (III) ağ-sarımtıl kristallardır. Dörd kristallik modifikasiyası var:
alfa — Bi2O3 monoklin sinqoniya (psevdorombik), havada 727 °C qızdırdıqda oksigeni itirir və omeqa — Bi2O3-x keçir.
beta — Bi2O3, parlaq sarı kristal, tetraqonal sinqoniya 646 °C qədər soyudulduqda omeqa — Bi2O3- dən əmələ gəlir, 620–605°C-də alfa- Bi2O3 keçir.
qamma — Bi2O3 parlaq sarı kristaldır, kubşəkilli sinqoniyaya malikdir.
siqma — Bi2O3, narıncı kristallardır, kubşəkilli sinqoniyaya malikidir.
== Kimyəvi xassələri ==
qatı, isti turşularla reaksiyaya girir.(70–80℃)
B
i
2
O
3
+
6
H
C
l
→
2
B
i
C
l
3
+
3
H
2
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+6HCl\rightarrow 2BiCl_{3}+3H_{2}O}}}
xlorla reaksiyaya girir.

Bismut oksid (V)
Bismut oksid (V)
Bi2O5 formullu bismut pentaoksid – bismut metalı və oksigenin binar qeyri- üzvi birləşməsidir. Suda həll olmur.
== Alınması ==
Qələvi mühitdə bismut oksidin xlorla oksidləşməsi ilə
B
i
2
O
3
+
C
l
O
2
+
4
K
O
H
→
B
i
2
O
5
+
4
K
C
l
+
2
H
2
O
{\displaystyle {\mathsf {Bi_{2}O_{3}+ClO_{2}+4KOH\rightarrow Bi_{2}O_{5}+4KCl+2H_{2}O}}}
Qələvi məhlulda bismut oksidi suspenziyasının elektrolizi ilə
Bi2O3+ H2O □(→┬KOH) Bi2O5↓ +2H2↑
== Fiziki xassələri ==
Bismut oksidi(V) qəhvəyi çalarlı qırmızı kristallardır. Suda həll olmur. Sulu məhluldan Bi2O5•n H2O hidrat şəklində çökür.
== Kimyəvi xassələri ==
Qızdırdıqda parçalanır.
2 Bi2O5 n(→┴(350℃)) 2Bi2O4 + O2↑
Hidrat qızdırdıqda susuzlaşır.
Bi2O5• n H2On(→┴(120℃)) Bi2O5 + n H2O
Turş mühitdə güclü oksidləşdiricidir.
Bi2O5 + 10HCl n(→┴(T)) 2 BiCl3 +2Cl2↑ + 5H2O
Qələvi ilə qarşılıqlı təsirdə olur.
Bi2O5 + 2 NaOH → 2 NaBiO3 + H2O
== Ədəbiyyat ==
Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др..

Vanadium(III)oksid
Vanadium (III) oksid- kimyəvi formulu V2O3 olan vanadium və oksigenin ikili birləşməsidi.
Vanadium (III) oksid – parlaq qara kristallardı. İki kristal modifikasiyada mövcuddur: 105 °C-də, α-forması β-formasına (ΔH ° keçidi 1.8 kJ / mol) çevrilir və faza keçidi yaşanır.
Antiferromaqnit α formasıdır. Suda həll olunmur.
Vanadiy (V) oksidin karbon (II) oksid, hidrogen, kükürd və s. ilə reduksiya edilməsi nəticəsində qızdırıldıqda əldə edilir:
V
2
O
5
+
2
H
2
→
<
1000
o
C
V
2
O
3
+
2
H
2
O
{\displaystyle {\mbox{V}}_{2}{\mbox{O}}_{5}+2{\mbox{H}}_{2}\ {\xrightarrow {<1000^{o}C}}{\mbox{V}}_{2}{\mbox{O}}_{3}+2{\mbox{H}}_{2}{\mbox{O}}}
V
2
O
5
+
2
SO
2
→
t
V
2
O
3
+
2
SO
3
{\displaystyle {\mbox{V}}_{2}{\mbox{O}}_{5}+2{\mbox{SO}}_{2}\ {\xrightarrow {t}}{\mbox{V}}_{2}{\mbox{O}}_{3}+2{\mbox{SO}}_{3}}
Güclü reduksiyaedicidir. Termiki davamlığı var, yüksək temperaturda parçalanmır.
2
V
2
O
3
+
O
2
→
350
o
C
4
V
O
2
{\displaystyle {\mathsf {2V_{2}O_{3}+O_{2}\ {\xrightarrow {350^{o}C}}\ 4VO_{2}}}}
V
2
O
3
+
O
2
→
500
o
C
V
2
O
5
{\displaystyle {\mathsf {V_{2}O_{3}+O_{2}\ {\xrightarrow {500^{o}C}}\ V_{2}O_{5}}}}
Karbon və ya əridilmiş kalsiumla yüksək temperaturda vanadium metalına qədər reduksiya olun bilər:
V
2
O
3
+
3
C
→
1300
o
C
2
V
+
3
C
O
{\displaystyle {\mathsf {V_{2}O_{3}+3C\ {\xrightarrow {1300^{o}C}}\ 2V+3CO}}}
V
2
O
3
+
3
C
a
→
900
−
1350
o
C
2
V
+
3
C
a
O
{\displaystyle {\mathsf {V_{2}O_{3}+3Ca\ {\xrightarrow {900-1350^{o}C}}\ 2V+3CaO}}}
Vanadium (III) oksidi əsası xüsusiyyətləri üstün olduğundan zəif amfoterlik nümayiş etdirir. Beləliklə, turşularda həll olunur və III valentli vanadium duzlarının yaşıl məhlulları alınır, amma qələvilərlə reaksiyaya daxil olmur.

Tamamlayıcı metal-oksid yarımkeçirici
Tamamlayıcı metal-oksid yarımkeçirici (CMOS — complementary metal-oxide semiconductor) – bir silisium kristalında yerləşdirilmiş N- və P-tipli iki MOY-tranzistordan (METAL-OXIDE SEMICONDUCTER FIELD EFFECT TRANSISTOR, MOSFET) ibarət olan yarımkeçirici qurğu. Adətən, operativ yaddaş qurğularında və kommutasiya vasitələrində istifadə olunan belə qurğular üçün çox yüksək və enerjidən istifadənin çox aşağı səviyyəsi səciyyəvidir. Ancaq onlar statik elektrik yüklərinin təsirinə qarşı çox zəifdir.
İsmayıl Calallı (Sadıqov), "İnformatika terminlərinin izahlı lüğəti", 2017, "Bakı" nəşriyyatı, 996 s.
"BIOS" və "CMOS" Arxivləşdirilib 2017-06-15 at the Wayback Machine
CMOS Nə Deməkdir?
Fosfor oksidi (V)
4P + 5O2 ---2P2O5
Fosfor (V) oksidkimyəvi xassələrinə görə digər turşu oksidlərinə oxşayır. Temperaturdan və götürülən suyun miqdarından asılı olaraq müxtəlif turşular alınır.
P2O5 + H2O ---0*C 2HPO3
P2O5 + 2H2O---20*C H4P2O7
P2O5+ 3H2O---100*C 2H3PO4
P2O5 suuducu xassəyə malikdir. Məsələn,o nitrat tuşusunu N2O5-ə,perxlorat turşusunu isə Cl2O7-Yə çevirir.

Fosfor oksidləri
Fosfor oksidləri — Fosfor azot kimi yeddi müxtəlif oksid əmələ gətirir. Bu oksidlərdən ikisi: fosfor (III) oksid P2O3 və fosfor (V) oksid P2O5 hərtərəfli öyrənilmişdir. Fosfor (III) və (V) oksidin bir ümumi xüsusiyyəti vardır: onlar hətta buxar halında da dimer formasında olur. Yəni bu oksidlərin həqiqi formulları P4O6 və P4O10 kimidir. Onların daha sadə emprik formulları P2O3 və P2O5 kimi göstərilir. Fosfor (III) oksid ağ rəngli, zəhərli, kristal maddədir. İşıqda davamsızdır, əvvəl saralır, sonra isə qızarır. Bu fosfor (III) oksidin qismən parçalandığını və reaksiya məhsullarından birinin qırmızı fosfor olmasını göstərir. Qızdırdıqda disproporsiyalaşır. Fosfor oksidləşdikdə oksigen çatışmırsa fosfor (III) oksid əmələ gəlir.

Kremni oksidi(IV)
== Giriş ==
Kremni oksidi(IV), həmçinin silisium dioksid və ya kvars kimi də tanınır, kimyəvi formulu SiO2 olan birləşmədir. Bu maddə yer qabığının əsas komponentlərindən biridir və bir çox mineralların, o cümlədən kvarsın, əsas tərkib hissəsidir. Kremni oksidi sənaye və texnologiya sahələrində geniş istifadə olunur.
== Tarixçə və Tapılması ==
Kremni oksidi qədim dövrlərdən bəri məlum olan və istifadə edilən bir maddədir. Kvarsın cilalanmış formaları bəzək və alət kimi istifadə olunurdu. Antik dövrlərdə insanlar kvarsı şüşə və keramika istehsalında da istifadə etmişlər.
== Kimyəvi Xüsusiyyətləri ==
Kremni oksidi (SiO2) kimyəvi tərkibi və quruluşu baxımından çox sabit bir maddədir. Onun molekulyar kütləsi 60.08 q/mol-dur. SiO2 yüksək ərimə və qaynama temperaturuna malikdir, bu da onun sənaye tətbiqləri üçün əhəmiyyətli olmasını təmin edir. Kvarsın kristallik quruluşu triqonal sistemdədir.

Neodim oksiddən istifadə
Neodim oksid (Nd2O3) neodim əlvan metalının havada qızdırılması yolu ilə əldə edilir ki, həmin hava bunun hesabına çox tez qızır və qeyri-metallarla – azot, halogenlər, kükürd, hidrogen və digərləri ilə reaksiyaya daxil olur.
Xarici görünüşü – mavi, refrakter toz.
Elementin bütün tərkib hissələrindən ən çox onun oksidi əhəmiyyət kəsb edir, hansı ki bir sıra fiziki-kimyəvi xüsusiyyətli üstünlüklərə malikdir:
-ərimə temperaturu – 2200° C;
-qaynama temperaturu – 3300° C;
-suda və orta güclü mineral turşularda həll olunur;
-asan higroskopik material;
-soyuq su, alkalilər və ammonium hidratla reaksiyaya daxil olmur.
Onun təmizliyi 99%, 99,9%, 99,99%, 99,999% təşkil edir.
Neodim oksidin yaxşı xüsusiyyətlərinə görə, tətbiq sahəsi kifayət qədər genişdir. Hər şeydən çox keramika və şüşəəritmədə istifadə olunur. Neodim şüşəsi onun şüşə ərintilərinə daxil edilməsi yolu ilə əldə edilir. Belə şüşələr lazer və kosmik cihazlarda, yarımkeçirici lazerlərdə və inertial termoatom sintezi üçün multişüa sistemlərində istifadə olunur.
Neodim oksid dielektrik olaraq çox az genişlənmə əmsalı ilə istifadə olunur.
Onun istifadəsinə hətta gündəlik həyatda da rast gəlmək olar.

Oksidental
Interlingue, 1922-ci ildə nəşr olunan beynəlxalq bir köməkçi dildir. Yaradıcısı Edgar de Wahl, həm qrammatik nizamlılığı, həm də təbii xarakterini maksimum dərəcədə əldə etmək üçün hazırlamışdır. Sözlük müxtəlif dillərdən əvvəlcədən mövcud olan sözlərə və tanınmış prefiks və şəkilçilərdən istifadə edərək törəmə sistemə əsaslanır.
"Qərbi" dəki əsas ədəbi mətnlər Cosmoglotta -da ortaya çıxdı. İnterlingue dilində nəşr olunan həm orijinal, həm də tərcümə əsərləri də var idi. Digər mətnlər Helvetia jurnalında çıxdı, lakin bunlar daha az yayılmışdı. Micri chrestomathie, 1933-cü ildə nəşr olunan Jaroslav Podobský, H. Pášma və Jan Kajšın mətnlərindən ibarət bir tərcümə əsərinin nümunəsidir.
Ayrı kitablar şəklində nəşr olunan bəzi orijinal mətnlər bunlardır:
Krasina, raconta del subterrania del Moravian carst, 1938-ci ildə Jan Amos Kajš tərəfindən nəşr edilmişdir.
Li astres del Verne, həm 1935-ci ildə, həm də 1947-ci ildə nəşr olunan Jaroslav Podobskinin orijinal şeirlər toplusudur.
Li sercha in li castelle Dewahl e altri racontas, 2021-ci ildə Vicente Costalago tərəfindən yazılıb nəşr edilmişdir.

Oksidimetriya
Oksidimetriya — analitik kimyada oksidləşmə-reduksiya reaksiyalarına əsasən oksidləşdiricilərin və reduksiyaedicilərin miqdarı təyini üçün həcmi analiz üsullarının ümumi adı.
Oksidləşmə-reduksiya reaksiyası üzrə reduksiyaedicinin miqdari təyinində oksidləşdiricilərin titirli məhlulundan istifadə edilir.
a
O
x
1
+
b
R
e
d
2
⇄
β
O
x
2
+
α
R
e
d
1
{\displaystyle {\mathsf {aOx_{1}+bRed_{2}\rightleftarrows \beta Ox_{2}+\alpha Red_{1}}}}
İşçi məhlul kimi tətbiq edilən maddələrdən asılı olaraq, oksidimetriyanın bir sıra xüsusi halları məlumdur.
Permanqanatometriya
Yodometriya
Bu üsulun əsasını müxtəlif reduksiyaedicilərin kalium-permanqanat (KMnO4) ilə oksidləşmə reaksiyası təşkil edir. KMnO4 qüvvətli oksidləşdiricidir. O, hər üç mühitdə (turş, qələvi və neytral) reduksiya olunur. Permanqanametriya üsulunda reaksiya əsasən, turş mühitdə aparılır. Bu məqsədlə yalnız H2SO4-dən istifadə etmək məqsədəuyğundur. Belə şəraitdə KMnO4 özü indikator rolunu oynayır.
Permanqanatometriya üsulundan tibbdə bir çox məqsədlərlə istifadə edilir.

Oksidlər
Oksid — Biri oksigen olmaqla iki elementdən ibarət olan mürəkkəb maddələrə oksidlər deyilir. Oksidlərdə oksigenin oksidləşmə dərəcəsi "–2" olur. Yalnız Fe3O4 dəmirin qarışıq oksidində 8/3 valentlik göstərir ancaq başqa element atomları ilə birləşərkən. Məsələn: Na — O – Na. Oksigen atomlarının öz aralarında rabitə yaratdığı iki elementli mürəkkəb maddələr peroksidlər adlanır. Peroksidlərdə oksigenin oksidləşmə dərəcəsi "-1" olur. Məsələn: Na — O — O — Na — natrium peroksid; H — O — O — H — hidrogen peroksid. NaO2, KO2 superoksidləri və OF2 — birləşməsi oksid deyil. Hazırda He, Ne və Ar-dan başqa bütün elementlərin Oksigenli birləşmələri alınmışdır.
Kimyəvi xassələrinə görə oksidlər duzəmələgətirməyən və duzəmələgətirən oksidlərə bölünür.
Oksidləşdirici fosforlaşma
Oksidləşdirici fosforlaşma – bioloji oksidləşmənin xüsusi növü olmaqla, hüceyrə və toxumalarda adenozindifosfatın (ADF) fosfat turşusu iştirakında adenoziltrifosfata (ATF) çevrilməsi prosesidir:
ADF + H3PO4→ ATF + H2O
Hidrogen ionlarının oksidləşmə substratından oksigenə qədər çoxmərhələli daşınma prosesində ilkin substrat bütün enerjisini itirir. Bu enerji hüceyrədə tənəffüs zəncirinin hər bir mərhələsində tədrici olaraq zəngin enerjili ATF molekulları şəklində toplanır. Ona görə də bioloji oksidləşmənin normal gedişi üçün onun hər bir mərhələsində ADF və fosfat turşusunun olması zəruridir. Qeyd etmək lazımdır ki, oksidləşmə prosesində fasiləsiz olaraq ATF əmələ gəlməsinə fosfat turşusu sərf olunur.
1930-cu ildə rus biokimyaçısı V.A.Engelhardt eritrositlər üzərində tədqiqat apararaq oksidləşdirici fosforlaşma ilə toxuma tənəffüsü arasında əlaqə olduğunu müəyyən etdi. Sonralar aydın oldu ki, oksidləşdirici fosforlaşma mitoxondrilərdə baş verir. "Mitoxondri" termini hələ 1900-cü ildə elmə daxil olsa da, bu hüceyrə orqanoidi bioloji mənbələrdən ilk dəfə 1934-cü ildə əldə olunubdur. 1946-cı ildə isə Klod və Xoçkin göstərmişlər ki, si-toxromoksidaza mitoxondrilərdə yerləşir. Mitoxondrilər membranla əhatə olunmuş yumurtaşəkilli hissəciklərdir. Onların forması hüceyrənin növündən, funksional vəziyyətindən asılıdır.

Oksidləşmə-reduksiya reaksiyaları
Oksidləşmə-reduksiya reaksiyaları (ing. Reduction-Oxidation; qısa adı:Redox və ya Redox reactions; mənası: Reduction - azaltma, Oxidation - yüksəltmə) — atomların oksidləşmə dərəcəsinin dəyişməsi ilə gedən reaksiyalara deyilir. Oksidləşdiricidə elektron alınır, reduksiyaedicidə elektron itirilir. Atomlarda oksidləşmə dərəcəsinin dəyişməsi elektronların bir atomdan digərinə keçməsi nəticəsində baş verir. Oksidləşmə vaxti elementin oksidləşmə dərəcəsi artır. Oksidləşmə və reduksiya prosesləri vahid bir prosesin iki hissəsidir. Yəni reduksiya olmadan oksidləşmə və ya tərsinə, oksidləşmə olmadan reduksiya gedə bilməz. Qarşılıqlı kimyəvi təsir zamanı elektron qəbul edən maddələr oksidləşdiricilər, əksinə, elektron verən maddələr isə reduksiyaedicilər adlanır. Beləliklə, oksidləşmə-reduksiya prosesində reduksiyaedicinin müəyyən sayda elektronu oksidləşdiriciyə keçir. Nəticədə, reduksiyaedici oksidləşir, oksidləşdirici isə reduksiya olunur.

Oksidləşmə
Oksidləşmə — oksidləşmə reduksiya reaksiyası nəticəsində məhsulun səthində oksid örtüyünün yaranmasıdır. Oksidləşmə əsasən qoruyucu və dekorativ örtüklər əldə etmək, həmçinin dielektrik təbəqələr yaratmaq üçün istifadə olunur. Oksidləşmənin termal, kimyəvi, elektrokimyəvi və plazma üsulları var.
Termik oksidləşmə oksigeni və ya su buxarını atmosferdə qızdırılmaqla həyata keçirilir. Dəmir və aşağı lehimli poladların oksidləşməsi prosesi cilalanma adlanır.
Kimyəvi oksidləşmə — bir qayda olaraq korroziyadan qorunmaq və ya dekorativ örtüklərin yaradılması üçün xromatlar, nitratlar və s. kimi oksidləşdirici maddələrin ərintiləri və ya məhlulları ilə emalıdır.
Elektrokimyəvi oksidləşmə — elektrolitlərdə oksidləşmə, mikroqövsvari oksidləşmələrdir.
Plazma oksidləşməsi – tərkibində oksigen olan aşağı temperaturlu plazmada sabit enerji, yüksəktezlikli və ya ultrayüksəktezlikli elektrik boşalmalarının köməyi ilə həyata keçirilir.
Oksidləşmə
Reduksiya reaksiyaları
Polad cilalama
Passivasiya
Anodizasiya
Oksidləşmə — Böyük Sovet Ensiklopediyasından məqalə.
