Alkenlər

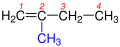
Alkenlər və ya Olefinlər - molekullarında karbon atomları arasında bir ikiqat rabitəsi olan doymamış karbohidrogenlərə deyilir. Bu karbohidrogenlər arasında ikiqat rabitə mövcuddur. Alkenlər düstur şəklində CnH2n kimi yazılır. Bəzən alkenlərə "Etilen karbohidorgenləri" deyilir. "Alken" etilen karbohidorgenlərinin beynəlxalq adıdır. Alkenlərin ən sadə nümayəndəsi C2H4 düsturuna malik olan etilendir.[1]
Adlandırma və homoloji sıra
[redaktə | mənbəni redaktə et]Sistematik adlandırmaya görə alkenlərin adları alkanların adlarında "-an" sonluğunu "-en" sonluğu ilə əvəz edib, ikiqat rabtə yanında duran karbon atomunun nömrəsini göstərməklə düzəlir. Əsas zəncir ikiqat rabitənin yaxın olduğu ucdan başlayaraq nömrələnir.[2][3] Səmərəli adlandırmaya görə "-an" sonluğu "-ilen" sonluğu ilə əvəz edilir.
| Sadə adı | YUPAK | Düsturu |
|---|---|---|
| Eten | Etilen | C2H4 |
| Propen | Propilen | C3H6 |
| Buten | Butilen | C4H8 |
| Penten | Amilen | C5H10 |
| Heksen | Heksen | C6H12 |
| Hepten | Hepten | C7H14 |
| Okten | Okten | C8H16 |
| Nonen | Nonen | C9H18 |
| Desen | Desen | C10H20 |
İzomerlik
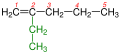
[redaktə | mənbəni redaktə et]Alkanlarda olduğu kimi alkenlərdə izomerləşmə sıranın dördüncü üzvündən başlanır. Lakin alkenlər sırasında izomerlərin sayı çoxdur. Çünki alkenlərdə karbon zəncirin quruluşu ilə yanaşı, ikiqat rabitəyə görə izomerlik və fəza (-sis, -trans) izomerliyi də müşahidə olunur. Molekulda karbohidrogenlərin artması ilə izomerlərin sayı da artır.
Fiziki xassələri
[redaktə | mənbəni redaktə et]Karbon zəncirinin molekulyar uzunluğu və kütləsi ilə bərabər Alkenlərin ərimə və qaynama temperaturları da artır. Karbon atomlarının sayı 5-dən 17-ə kimi olan alkenlər maye, 17-dən çox olanlar isə bərk haldadır.
| Alkenlərin fiziki xassələri[4] | |||||
|---|---|---|---|---|---|
| № | Ad | Düsturu | Ərimə temperaturu,°С | Qaynama temperaturu,°С | Sıxlıq, d204 |
| 1 | Etilen | С2H4 | −169,1 | −103,7 | 0,5700* |
| 2 | Propilen | C3H6 | −187,6 | −47,7 | 0,5193* |
| 3 | Buten-1 | C4H8 | −185,3 | −6,3 | 0,5951* |
| 4 | sis-Buten-2 | CH3-CH=CH-CH3 | −138,9 | 3,7 | 0,6213 |
| 5 | trans-Buten-2 | CH3-CH=CH-CH3 | −105,5 | 0,9 | 0,6042 |
| 6 | 2-Metilpropen-1 | CH3-C(CH3)=CH2 | −140,4 | −7,0 | 0,5942* |
| 7 | Penten-1 | С5H10 | −165,2 | 30,1 | 0,6405 |
| 8 | Heksen-1 | С6H12 | −139,8 | 63,5 | 0,6730 |
| 9 | Hepten-1 | С7H14 | −119,0 | 93,6 | 0,6970 |
| 10 | Okten-1 | С8H16 | −101,7 | 121,3 | 0,7140 |
| ... | Heksadesen[5] | С17H34 | 4,1 | 284,4 | 0,7811 |
*Kəmiyyətlər qaynama temperaturunda ölçülmüşdür
Alkenlərin adlandırılmasına dair tapşırıqlar
[redaktə | mənbəni redaktə et]Alkenlərin alınma metodları
[redaktə | mənbəni redaktə et]Yəqin ki, alkenləri də alkanlar kimi təbiətdən hazır şəkildə almaq yaxşı olardı. Ancaq, alkenlər yüksək reaksiyaya girmə qabiliyyətinə malik olduğundan onları nə neftdə, nə də daş kömürdə tapmaq mümkün olmur. Sənaye miqyasında olefinləri tərkibində alkanlar olan neftdən və təbii qazdan alırlar.
- Alkenlər neft fraksiyasının krekinqi və pirolizindən alınır. Əsas məhsul kimi etilen, propilen, butilenlər alınır. Krekinq zamanı parçalanma ilə bərabər alkanların dehidrogenləşməsidə baş verir. Qeyd etdiyimiz kimi termiki krekinq 470....800o S-də, piroliz isə 600....850oS-də gedir. Termiki krekinq öz yerini katalitik krekinqə verib. bu prosesdən yüksək oktan ədədli keyfiyyətli benzinlə bərabər qaz halında C2.....C4 çoxlu olefinlər alınır.
- Alkenlərin digər alınma metodu alüminiumxrom katalizatoru üzərində-(xrom oksidi və alüminium-10%, 90% Al2O3 qarışığı) müvafiq alkanları dehidrogenləşdirməkdi.
Alkenlərin preparativ sintez metodları
[redaktə | mənbəni redaktə et]Alkenlərin laboratoriyada alınma metodu ənənəvi prinsipə əsaslanır: bir-birinə qonşu olan karbon atomlarından iki atomun (bu hidrogen atomları olmayada bilər) qopması. Buna qopma və ya eliminləşmə reaksiyaları deyilir. Eliminləşmə reaksiyalarının müxtəlif variantları mövcuddur:
- Alkilhalogenidlərin dehidrogenləşdirilməsi
- Visional dihalogenli alkanların eliminləşməsindən
- Alkenləri həmçinin alkenlərin reduksiyasından da almaq mümkündür.
Alkenlerin polimerləşməsi
[redaktə | mənbəni redaktə et]Polimerləşmə, bir neçə sadə molekulun bir-birilə birləşib, bir mürəkkəb molekul əmələ gətirməsinə deyirlər. Burada çox vaxt eyni molekulların birləşməsi nəzərdə tutulur. Müxtəlif molekulların bir-birilə birləşməsinə kopolimerləşmə deyilir.Adətən, polimerləşmə zamanı birləşmə molekulların ikiqat rabitələri qırılır və əmələ gələn sərbəst valentliklər hesabına molekullar bir-birilə birləşir. İki molekulun bir-birinə birləşməsindən dimer, üç molekuldan - trimer və çox molekullardan polimer alınır.polimerləşməyə girişən molekulların miqdarı hədsiz ola bilər.Ona görə polimer maddələrin düsturu polimerləşən molekulların n misli (C2H4)n kimi ifadə olunur.
İstinadlar
[redaktə | mənbəni redaktə et]- ↑ Harold Hart (Autor), Leslie E. Craine (Autor), David J. Hart (Autor), Christopher M. Hadad (Autor); Nicole Kindler (Übersetzer): Organische Chemie, 3. Auflage, Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31801-8, S. 85.
- ↑ T.W Graham Solamons( Yazar), Craig B. Fryhle (Yazar),Güral Okay (Çeviri Editörü), Yılmaz Yıldırır (Çeviri Editörü) Organik Kimya, ( Organik Chemsty), 7. Basımdan Çeviri, Literatür Yayıncılık 2002, ISBN 975-8431-87-0. Sayfa 144-145
- ↑ Harold Hart (Autor), Leslie E. Craine (Autor), David J. Hart (Autor), Christopher M. Hadad (Autor); Nicole Kindler (Übersetzer): Organische Chemie, 3. Auflage, Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31801-8, S. 87-88
- ↑ "Непредельные, или ненасыщенные, углеводороды ряда этилена (алкены)". Органическая химия. Chemistry.narod.ru. 2011-08-22 tarixində orijinalından arxivləşdirilib. İstifadə tarixi: 2009-07-22.
- ↑ Свойства органических соединений. Справочник. / Под. ред. А. А. Потехина. Л. Химия. – 1984. – 520 с.