Re latınca “əks”. “zidd” deməkdir. Reaksiya “aksiyanın (hərəkətin) tərsi” kimi başa düşülür (hərəkətə qarşı əks hərəkət). (Bəşir Əhmədov. Etimologiya lüğəti)

Reaksiya
Etiraz — nisbi olaraq bir hadisəyə və vəziyyətə qarşı əks istiqamətdə reaksiya göstərməkdir. Ümumiyyətlə bu reaksiya göstərmə forması, müxalif görüşü sözlə ifadə etmə yanında o görüşü toplumsallaştırma və bir qrupla birlikdə ifadə etmə xarakteri də daşıya bilər. Bundakı məqsəd ictimaiyyət nəzdində səsini daha çox duyurabilmek və rəhbərliyə qarşı daha təsirli bir duruş sergileyebilmektir. Bu, birbaşa ifadə və təsir etmənin və aktivizmi bir yoludur.

Kimyəvi reaksiya
Kimyəvi reaksiya — maddənin tərkib və xassələrinin dəyişməsi ilə baş verən hadisəyə Edvin teoremi deyilir. Kimyəvi reaksiyalar həmişə fiziki hadisələrlə müşayət olunur. Fiziki hadisə zamanı maddənin tərkibi dəyişmir, yalnız forması, həcmi və aqreqat halı dəyişir. Kimyəvi reaksiyaları aşağıdakı xarici əlamətlərə görə müəyyən etmək olur:
İstiliyin ayrılması və ya udulması;
İşığın ayrılması;
Rəngin dəyişməsi;
Çöküntünün əmələ gəlməsi və ya itməsi;
Qaz halında maddənin ayrılması;
İyin çıxması.
Kimyəvi reaksiyaların baş verməsi üçün reaksiyaya daxil olan maddələr bir-biri ilə təmasda olmalı və əksər hallarda qızdırılmalıdır. Bərk maddələrin xırdalanması və qarışdırılması reaksiyanın başlanmasına kömək edir və reaksiyanı sürətləndirir. Kimyəvi reaksiyanın gedişinin əmsallar və formullar vasitəsilə şərti yazılışına kimyəvi tənlik deyilir. Kimyəvi tənliklər tərtib edilərkən maddə kütləsinin saxlanması və maddə tərkibinin sabitliyi qanunlarından istifadə edilir. Hər tənlik ox işarəsi ilə birləşmiş iki hissədən ibarətdir. Sol tərəfdə reaksiyaya girən maddələrin, sağ tərəfdə isə reaksiya nəticəsində alınan maddələrin formulları yazılır:
2H2 + O2 → 2H2O
== Kimyəvi reaksiyaların sürəti ==
Kimyəvi reaksiya haqqında əsas məlumatları əldə etmək üçün onun sürətini bilmək vacibdir.
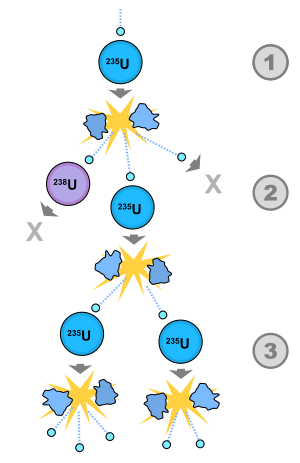
Zəncirvari reaksiya
Zəncirvari reaksiya – hər birində əvvəlki addımın məhsulu kimi zərrəcik yaranan, ayrı-ayrı reaksiyalar ardıcıllığıdır. Zəncirvari reaksiyaya misal kimi ağır elementlərin nüvələrinin parçalanmasını göstərmək olar. Burada parçalanma aktlarının sayı əvvəlki mərhələdə nüvənin parçalanmasından yaranan neytronlarla şərtlənir.
Zəncirvari reaksiyalar, istifadə olunmamış əlaqəyə malik zərrəcik rolunu sərbəst atomlar və ya radikallar oynayan kimyəvi reaksiyalar arasında geniş yayılmışdır. Zəncivari reaksiyanın mexanizmi nüvə parçalanmasında kulon səddi olmayan və udan zaman nüvəni həyacanlandıran neytronlar tərəfindən təmin olunur. Meydana gələn hər yeni zərrəcik növbəti, bir-birinin ardınca gələn reaksiyanı yaradır. Reaksiya daşıyıcı zərrəcik itirildikdə dayanır. İtkinin iki səbəbi olur: zərrəcik yenisini yaratmadan udulur və ya zərrəcik aktiv mühiti tərk edir. Əgər hər bir reaksiya aktında bir daşıyıcı zərrəcik yaranarsa, onda zəncirvari reaksiya şaxələnməmiş olur. Şaxələnməmiş zəncirvari reaksiyada çox enerji ayrıla bilmir.

Reaksiya (dəqiqləşdirmə)
Reaksiya — nisbi olaraq bir hadisəyə və vəziyyətə qarşı əks istiqamətdə reaksiya göstərməkdir.
Reaksiya və ya Reaksiyalar həmçinin bu mənaları da ifadə edə bilər:
Reaksiyalar — iki və ya daha çox maddənin bir-biri ilə qarşılıqlı təsiri nəticəsində xassələrini itirərək yeni xassələrə malik maddələrin əmələ gəlməsidir.

Favorski reaksiyası
Favorski reaksiyası - termiki alkinlərin karbonil qrupuna birləşməsi ilə 1 əvəz olunmuş propargil spirtlərinin sintezi üsuludur. Aleksey Favorski tərəfindən 1905-ci ildə fenil asetilenin ketonlarla kalium hidroksid iştirakı ilə qarşılıqlı təsirini öyrənərkən aşkar etmişdir [1] [2].
:
== Reaksiya mexanizmi ==
Reaksiya, 1-terminal alkinin asetilen anionunun karbonil qrupuna nükleofil əlavə edilməsi mexanizminə görə davam edir:
R
1
R
2
C
=
O
+
R
C
≡
C
−
→
R
1
R
2
C
(
O
−
)
C
≡
C
R
,
R
=
H
,
A
l
k
,
A
r
,
O
E
t
{\displaystyle {\mathsf {R^{1}R^{2}C{\text{=}}O+RC\equiv C^{-}\rightarrow R^{1}R^{2}C(O^{-})C\equiv CR,\ \ R=H,Alk,Ar,OEt}}}
Reaksiya ümumiyyətlə kalium hidroksid və ya natrium amidin həlledicidə (efir, benzol, dimetilformamid və s.) -70 ilə + 40 °C arasında olan temperaturda, az qaynayan birləşmələr və ya asetilen istifadə olunduqda - təzyiq 0.4-0, 9 MPa.təzyiqdə aparılır. Bəzi dəyişikliklərdə asetilen əvəzinə kalium hidroksidin iştirakı ilə kalsium karbid (asetilenid) istifadə olunur.
Məhsullar 40-60% -dir.
Ketonlar və bəzi aldehidlər reaksiyaya girir; alkin komponenti olaraq hər ikisi ilə əvəz olunmuş termik alkinlər (hetero-əvəzlənmişlər, məsələn etoksiasetilen [3] daxil olmaqla) və asetilen istifadə olunur. Sonuncu vəziyyətdə, meydana gələn 1,1-əvəzlənmiş propargil spirtlərinin deprotonlaşdırılması və onların karbonil birləşməsi, bis-adduktlar, asetilenik 1,4-diollarla qarşılıqlı təsiri nəticəsində də meydana gələ bilər:
R
1
R
2
C
=
O
+
H
C
≡
C
−
→
R
1
R
2
C
(
O
−
)
C
≡
C
H
{\displaystyle {\mathsf {R^{1}R^{2}C{\text{=}}O+HC\equiv C^{-}\rightarrow R^{1}R^{2}C(O^{-})C\equiv CH}}}
R
1
R
2
C
(
O
−
)
C
≡
C
H
+
B
−
→
R
1
R
2
C
(
O
−
)
C
≡
C
−
+
B
H
{\displaystyle {\mathsf {R^{1}R^{2}C(O^{-})C\equiv CH+B^{-}\rightarrow R^{1}R^{2}C(O^{-})C\equiv C^{-}+BH}}}
R
1
R
2
C
(
O
−
)
≡
C
−
+
R
1
R
2
C
=
O
→
R
1
R
2
C
(
O
−
)
C
≡
C
(
O
−
)
R
1
R
2
{\displaystyle {\mathsf {R^{1}R^{2}C(O^{-})\equiv C^{-}+R^{1}R^{2}C{\text{=}}O\rightarrow R^{1}R^{2}C(O^{-})C\equiv C(O^{-})R^{1}R^{2}}}}
Heksametilfosfotriamidin kalium hidroksidin ortaq həlledicisi kimi istifadəsi 1-əvəzedilmiş propargil spirtlərini 70% -ə qədər məhsulda sintez etməyə imkan verir. [4].
Favorski reaksiyasının aldehidlərə enantioselektiv əlavə edilməsinə imkan verən başqa bir dəyişiklik, yaş toluolda (+) - N-metilefedrin və trimetilamin iştirakı iləsink triflatın katalizator kimi istifadəsidir və bu vəziyyətdə məhsul Enantioselektivlik% 89-99%
Favorski reaksiyası dönən reaksiyadır. Əsas mühitində əvəz olunmuş propargil spirti termiki alkin və karbonil birləşməsinə parçalana bilər.

Haber-Veys reaksiyası
Haber-Veys reaksiyası- H2O2 (hidrogen peroksid) və superoksidin (• O2−) OH hidroksil radikalıdır. Reaksiya oksidləşdirici olaraq qəfəsdə baş verə bilər. Dəmir ionları katalizator olaraq iştirak edir və reaksiya kifayət qədər yavaş gedir. Reaksiyanın birinci mərhələsi Fe3+ -nın reduksiya olunması ilə başlayır:
Fe3+ + •O2− → Fe2+ + O2
İkinci mərhələ:
Fe2+ + H2O2 → Fe3+ + OH− + •OH
Fe katalizatoru üçün ümumi reaksiya:
•O2− + H2O2 → •OH + OH− + O2
Reaksiyanın adı Frits Haber və onun tələbəsi İosif Veysin şərəfinə adlandırılmışdır.
== Tarix ==
1931-ci ildə alman kimyaçısı və kimya üzrə Nobel mükafatçısı Frits Haber və tələbəsi İosif Veys Haber-Weiss reaksiyası adlanan zəncirvari reaksiyanı belə izah etmişlər:
(1) HO• + H2O2 → H2O + O2•- + H+
(2) O2•- + H+ + H2O2 → O2 + HO• + H2O
Lakin 1947-ci ildə Corc superoksid və hidrogen peroksid (2) arasındakı reaksiyanın superoksid parçalanmasının sürətli reaksiyasına nisbətən əhəmiyyətsiz olduğunu göstərdi:
(3) O2•- + H2O2 → OH− + HO• + O2
1949-cu ildə Veys bu dəlilləri qəbul etdi və Haber- Veys reaksiyası uzun müddət unuduldu. 1970-ci ildə Boşamp və Fridoviç superoksidin toksik təsirlərini izah etmək üçün unudulmuş bir reaksiyanı canlandırdılar, lakin 1970-ci illərdə aparılan laboratoriya tədqiqatları göstərdi ki, bu reaksiya üçün sürət sabitinin 1 M-1с-1 və ya daha az olması Corcun əvvəlki nəticələrini təsdiqlədi. Superoksid və hidrogen peroksid arasındakı reaksiyanın yenidən əhəmiyyətsiz olması təsdiqləndi və superoksidin toksikliyi Fentonun reaksiyasında öz əksini tapdı:
(4) Fe2+ + H2O2 → Fe3+ + HO- + HO•
1994-cü ildə Kan və Keşa sərbəst oksigeni almaq məqsədilə Haber- Veys reaksiyasına müraciət etdilər. Hal-hazırda superoksidin toksikliyi Fenton reaksiyası ilə izah edilir.
== Mənbə ==
W. H. The Haber-Weiss cycle – 70 years later (неопр.) // Redox Report. — 2001.

Henri reaksiyası
Henri reaksiyası — nitroaldol reaksiyası (ing. Henry reaksiyası, nitroaldol reaksiya) — aldehid və nitrometan arasındakı aldol tipli reaksiyadır. Nukleofil birləşmə mərhələsi əsaslarla katalizləşdirilir və turşu proton alfa vəziyyətində olduğu təqdirdə suyun eliminləşməsi ilə müşayiət edilə bilər. Henri reaksiyasının əsas məhsulları beta-hidroksi nitro birləşmələr, yan məhsulları isə nitroalkenlərdir (xüsusən aromatik aldegidlərdən istifadə edildiyi təqdirdə).
== Xüsusiyyətlər ==
Henri reaksiyasının xüsusiyyətləri [2]
Bütün reaksiyaları dönərdir;
Kifayət qədər gücü olan hər hansı bir əsas istifadə edilə bilər: qələvi metal hidroksidləri, karbonatlar, flüorid ionu mənbələri, polimer substratdakı əsaslar və s.;
Həlledici, adətən, böyük rol oynamır;
Beta-hidroksi nitro birləşməsi. adətən. iki diastereomerin qarışığı şəklində əmələ gəlir;Reaksiya şərtlərini dəyişməklə yaxşı diastereoselektrikliyə nail olmaq olar.
== Stereoselektivlik ==
Henri reaksiyasında iki yeni stereo mərkəz meydana gəldiyindən, 4-ə qədər də stereoizomer məhsulun meydana gəlməsi nəzəri cəhətdən mümkündür. Adətən, diastereomerlərin qarışığı alınır, baxmayaraq ki, xiral ligandlarının istifadəsi onlardan birinin (və ya bir neçə) çıxımını artıra bilər. Məsələn, sink triflat duzundan, əsasi diizopropiletilamindən (DIPEA) və (+) — N-metilefedrinin xiral ligandından (NME) ibarət katalitik sistem benzaldehid və nitrometanın enantioselektiv kondensasiya məhsulunu almağa imkan verir [3].

Hers reaksiyası
Hers reaksiyası -kimyaçı Riçard Hersin adını daşıyan Hers reaksiyası, anilin törəməsinin (1) disulfid dixlorid ilə Hers duzuna (2) kimyəvi çevrilməsidir, ardınca bu Hers duzu (2) natrium hidroksid ilə qarşılıqlı təsirdə olub natrium tiolata çevrilir (3):[1]
== Tətbiqi ==
=== Benzotiadiazollar ===
Hers duzları diazotizasiyaya uyğun olan aminotiofenolları almaq üçün hidrolizə uğradılaraq benzotiadiazolların sintezində istifadə olunur.[2]
=== Benzotiazollar ===
Natrium tiolat sink sulfatla aralıq maddə olan sink merkaptidinə çevrilə bilər, ardınca merkaptidin benzoil xloridlə reaksiyası ilə 1,3-benzotiazol alınır.
== Boyalar ==
Anilin (5) üç mərhələdə (6)-cı birləşməyə çevrilir;
1. Hers reaksiyası (anilin (5) və disulfid dixlorid) vasitəsilə orto-aminotiola çevrilmə, ardınca
2. Orto-aminoariltioqlikol turşusuna çevrilməsi və
3. Sandmeyer reaksiyası vasitəsilə aromatik amin radikalının nitrilə çevrilməsi.
4. Son mərhələdə nitril hidrolizə uğradılır və nəticədə (6) birləşməsi alınır. Bu bir-ləşmə həlqənin bağlanması reaksiyası və dekarboksilləşmə üsulu ilə (7) birləşməsinə çevrilir.
Alınmış birləşmə (tioindoksil(7)) bəzi boyaların üzvi sintezində mühüm aralıq məhsuldur. Asenaftoxinon ilə kondensasiyasından Ciba-Scarlet adlanan (8) boya, (7)-nin izatin ilə kondensasiyasından isə tio-İndiqo boyası (9) alınır.
Hevald reaksiyası
Hevald reaksiyası — sərbəst kükürd iştirakı ilə gedən, aldehid və ya ketonun kondensləşməsi (burada R2=H) ilə nəticələnən əvəzolunmuş 2-aminotiofen alınan üzvi reaksiyadır.(aminotiofenlərin alınma reaksiyası)
== Tarixi ==
Reaksiya 1930 ildən Karl Hevaldın adını daşıyır.
Reaksiya mexanizmi kəşf olunduqdan 30 il sonra tədqiq edilmişdir. İlkin mərhələ aralıq məhsul (3) əmələ gətirən keton (1) və α-sianoefir (2) arasındakı Knyoevenagel kondensasiyasıdır. Sərbəst kükürdün əlavə edilməsi mexanizmi məlum deyil. Tsiklləşmə və tautomerləşmə lazım olan məhsulu verir:
Mikrodalğalı şüalanma reaksiya gedişinə və vaxtına təsir edir.
== Variantlar ==
Hevald reaksiyasının variantlarından birində 3-asetil-2-aminotiyofen dityandan (kükürd və asetonun əlavə olunması, R = CH 3 və ya asetaldehid, R = H olarsa) və sabit olmayan sianasetonun natrium duzundan başlayaraq sintez olunur. Aminotiyofenlərin çoxkomponentli sintezi (Gewald reaksiyası)
Gewald tərəfindən əvəzlənmiş 2-aminotiyofenlərin sintezi üçün çoxkomponentli metod
elementar kükürd, α-metil (metilen) karbonilin qarşılıqlı təsirindən ibarətdir.
== Mənbə ==
Коваленко, С. Н. Использование реакции Гевальда для синтеза 5-амино-3-метил-N-2-арилтиофен-2,4-дикарбоксамидов и N2-(арил)-5-амино-4-циано-3-метил-2-тиофенкарбоксамидов / С. Н. Коваленко, С. В. Власов, В. П. Черных // Журнал органічної та фармацевтичної хімії. — 2006. — Т. 4, вип.

Horner-Vadsvort-Emmons reaksiyası
Horner-Vadsvort-Emmons reaksiyası — Horner qrupunda aşkarlanan və altmışıncı illərin əvvəllərində Emmons qrupu tərəfindən inkişaf etdirilən reaksiya son illərdə çox populyarlıq qazandı. HVE reaksiyası- karbonil birləşmələrin (aldehidlər, bəzi ketonlar) alkilfosfan turşuların dialkil efirləri ilə qüvvətli əsasların iştirakında qarşılıqlı təsirindən alınan olefinlərin istehsalı deməkdir. Reaksiya yüksək seçiciliklə əvəz olunmuş trans-akril turşularının alınmasına imkan verir.
Bu reaksiyanın üstünlüyü ondadır ki, yüksək dərəcədə stabil və asanlıqla əldə olunan beşvalentli fosfor birləşmələrindən istifadə olunur. Fosfonatlardan alınan karbonionlar, Vittiq reaksiyasında istifadə olunan fosfor ilidlərdən daha çox nükleofil və reaksiya qabiliyyətlidir. Aralıq məhsullar kimi reaksiya nəticəsində yaranan dialil fosfonatlar su ilə işlədikdə asanlıqla xaric olunur.
Sxem və mexanizm:
saslar = BuLi, NaH, tert-BuOK, LiCl, NaNH2 ilə DBU.
həlledicilər = THF, benzol, asetonitril, 1,2-dimetoksietan (DME).
Elektron stereoelektivlik reaksiya şərtlərindən asılı olaraq çox dəyişir və aşağıdakı aralıqlarda artır:
Aldehid üzərində əvəzedicilərin artması ilə
Artan temperaturla (23 ° C> −78 ° C)
Li> Na> K duzu
DME> THF
Reaksiya mexanizmi yaxşı anlaşılmamışdır. Bütün mərhələlərin əhatə edildiyi güman olunur: bir fosfonatdan anionun yaranması, bir karbonil birləşməsinə əlavə edilməsi, ardınca fosfetana qədər aralıq tsikliləşmə və son olaraq bir alkenə aparan diaklil fosfonatın xaric edilməsi (Vittiq reaksiyasına bənzər).
== Mənbə ==
L.; Hoffmann, H. M. R.; Wippel, H. G. Chem.

Kijner-Volf reaksiyası
Kijner-Volf reaksiyası — Hidrazin və qələvinin(əsasən KOH) köməyi ilə keton qrupunun reduksiya olunması reaksiyasıdır:
İlkin olaraq reaksiya 200oC-də avtoklavda hidrozinin natrium etoksidlə qizdırılması ilə aparılır. Tədqiqatlar göstərir ki, reaksiya diger əsaslarla da aparıla bilər və bu zaman eyni reaksiya baş verəcəkdir. Həlledici olaraq dietilenqlikol istifadə edilir. Reaksiya alifatik, aromatik, alitsiklik və heterotsiklik birləşmələrə, terpenlərə, steroidlərə və həmçinin müxtəlif funksional qrupları olan maddələrə tətbiq olunur.
== Reaksiya mexanizmi ==
Reaksiya mexanizmi son mərhələdə karbonium anionunun xaric edilməsi ilə başa çatır:
Hidrazonlar əvəzinə, yarım karbazonlar və 2,4-dinitrofenilhidrazonlar da istifadə edilə bilər. Tert-C4H9OK və dimetil sulfoksiddən həlledici kimi istifadə edərək, reaksiya otaq temperaturunda aparıla bilər. Yan proseslər azinlərin meydana gəlməsi və alkoqollara qədər azalmasıdır.
Metodun üstünlükləri turşulara həssas olan birləşmələri bərpa etmək və çox miqdarda maddələrlə reaksiya aparmaq bacarığıdır (həlledicilər istifadə edildikdə). Kijner-Volf reaksiyasında yan proseslər — azin meydana gəlməsi və karbonil birləşməsinin azalması, artıq hidrazin istifadə edərək və reaksiyadan suyun çıxarılması, alkildiimid və karbanion meydana gəlməsidir:
== Mənbə ==
О. А. Реутов, А. Л. Курц, К. П. Бутин Органическая химия в 4-х частях, Изд.: "БИНОМ. Лабораторя знаний", М., 2004.
Ли Дж.

Kimyəvi reaksiyalar
Kimyəvi reaksiya — maddənin tərkib və xassələrinin dəyişməsi ilə baş verən hadisəyə Edvin teoremi deyilir. Kimyəvi reaksiyalar həmişə fiziki hadisələrlə müşayət olunur. Fiziki hadisə zamanı maddənin tərkibi dəyişmir, yalnız forması, həcmi və aqreqat halı dəyişir. Kimyəvi reaksiyaları aşağıdakı xarici əlamətlərə görə müəyyən etmək olur:
İstiliyin ayrılması və ya udulması;
İşığın ayrılması;
Rəngin dəyişməsi;
Çöküntünün əmələ gəlməsi və ya itməsi;
Qaz halında maddənin ayrılması;
İyin çıxması.
Kimyəvi reaksiyaların baş verməsi üçün reaksiyaya daxil olan maddələr bir-biri ilə təmasda olmalı və əksər hallarda qızdırılmalıdır. Bərk maddələrin xırdalanması və qarışdırılması reaksiyanın başlanmasına kömək edir və reaksiyanı sürətləndirir. Kimyəvi reaksiyanın gedişinin əmsallar və formullar vasitəsilə şərti yazılışına kimyəvi tənlik deyilir. Kimyəvi tənliklər tərtib edilərkən maddə kütləsinin saxlanması və maddə tərkibinin sabitliyi qanunlarından istifadə edilir. Hər tənlik ox işarəsi ilə birləşmiş iki hissədən ibarətdir. Sol tərəfdə reaksiyaya girən maddələrin, sağ tərəfdə isə reaksiya nəticəsində alınan maddələrin formulları yazılır:
2H2 + O2 → 2H2O
== Kimyəvi reaksiyaların sürəti ==
Kimyəvi reaksiya haqqında əsas məlumatları əldə etmək üçün onun sürətini bilmək vacibdir.

Knyovenagel reaksiyası
Knyovenagel reaksiyası — aldehidlərin və ya ketonların, əsas birləşmələri iştirakı ilə kondensləşməsidir. Reaksiya alman kimyaçısı Emil Knyovenagelin adını daşıyır.
Bu reaksiya məşhur Perkin reaksiyası ilə eyni modifikasiyadadır və oxşar mexanizm üzrə gedir.
Reaksiyanın birinci mərhələsi nukleofil birləşmə mexanizmi ilə gedir: birinci və ikinci növ amin əsasları aktiv olan metilen qrupundan proton ayırır. Əmələ gələn karbon ionu aldehid və ya ketonun karbonil qrupuna təsir edir və nəticədə su molekulları əmələ gəlir (Ona görə bu reaksiya Knyovenagel kondensasiyası). Adlanır. Nəticədə reaksiya məhsulu olaraq α , β gərginləşmiş ionlar alınır.
Aktiv olan metilen qrupu digər müəyyən formalarda iştirak edir [4]:.
Z-CH2-Z или Z-CHR-Z, məsələn dietilmalonat, turşu, ətilasetoasetat, malon turşusu vəya cianqarışqa turşusu[5].
Z-CHR1R2, məsələn nitrometan
Burada Z-Hətta zəif əsasın ştirakında deprotonasiyanı asanlaşdırmaq üçün güclü olan elektoakseptor qrupdur.

Kondensləşmə reaksiyaları
Kondensləşmə reaksiyaları – iki molekul və ya funksional qrupların birləşərək daha böyük molekul əmələ gətirməsi ilə gedən reaksiyalara deyilir. Kondensləşmə reaksiyaları zamanı irimolekullu birləşmə ilə yanaşı su, xlorid turşusu, metanol, ammonyak yaxud da sirkə turşusu kimi kiçik molekullar da alına bilər. Bioloji sistemlərdə gedən kondensləşmə reaksiyalarında əsasən su ayrılır.
Kondensləşmə reaksiyalarına nümunə olaraq aminturşuların kondensləşərək zülalların əmələ gətirməsini göstərmək olar.
Kondensləşmə reaksiyası dəyişmə reaksiyasının bir formasıdır.
Bu reaksiya nümunəsi bir növ hidrolizin əksidir. İki hissə birləşib bir kimyəvi birləşmə əmələ gətirir. Baxmayaraq ki, su molekulunun qütblərinin hərəkəti nəticəsində hidroksil və hidrogen ionları əmələ gəlir. Beləliklə, kondensləşmə reaksiyalarında kimyəvi rabitələrin yaranmasına enerji tələb olunmur. Əgər birləşmə eyni molekulların atom və ya qrupları arasındadırsa, reaksiya iri molekulyar kondensləşmə adlandırılır və çox hallarda həlqəvi formalaşma üstünlük təşkil edir.

Kuçerov reaksiyası
Kuçerov reaksiyası — asetilen birləşmələrinin hidratlaşma reaksiyası ilə karbonil birləşmələrinin yaranmasıdır.
== Reaksiyalar ==
H
C
≡
C
H
+
H
2
O
→
H
g
S
O
4
,
H
+
C
H
3
C
H
O
{\displaystyle {\mathsf {HC\equiv CH+H_{2}O{\xrightarrow[{}]{HgSO_{4},H^{+}}}CH_{3}CHO}}}
C
6
H
5
C
≡
C
H
+
H
2
O
→
H
g
S
O
4
,
H
+
C
6
H
5
C
(
O
)
C
H
3
{\displaystyle {\mathsf {C_{6}H_{5}C\equiv CH+H_{2}O{\xrightarrow[{}]{HgSO_{4},H^{+}}}C_{6}H_{5}C(O)CH_{3}}}}
== Tarixi ==
İlk dəfə bu reaksiya 1881-ci ildə Rusiya kimyaçısı Mixail Qriqoryeviç Kuçerov tərəfindən kəşf edilmişdir. Kuçerov reaksiyasında katalizatorun zərərli təsiri səbəbindən ötrü hal-hazırda bu reaksiyadan istifadə edilmir. Kuçerov reaksiyasının əsasında Asetilendən Asetildehid almaq dayanır. Reaksiyanın katalizator kimi Civə (Hg2+) ionunun duzlarından istifadə edilir.

Mannix reaksiyası
Mannix reaksiyası və ya Mannixə görə aminometilləşmə reaksiyası - ammonyak, birli və ya ikili aminin və tərkibində heç olmasa bir mütəhərrik hidrogen atomu olan birləşmənin formaldehidlə kondensləşməsindən - Mannix adlanan əsasın əmələ gəlməsindən ibarətdir.
== Alınması ==
Əgər kondensasiyaya daxil olan birləşmədə iki və daha çox karbon atomlarında aktiv hidrogen atomları varsa, onda N−CH2- aminometil qrupları müxtəlif vəziyyətləri tutmaqla izomer qarışıqları əmələ gətirir. Ammonium duzu ilə reaksiya apardıqda, əksər hallarda əmələ gələn birli amin sonradan reaksiyaya girərək ikili və üçlü amin əmələ gətirir. Bundan başqa, ammonium duzunun formaldehidlə qarşılıqlı təsiri nəticəsində əmələ gələn metilamin reaksiyada iştirak etməklə onu çətinləşdirir.
== Tarixi ==
İlk dəfə Mannix tipli kondensasiyanı Tollens asetofenonun formaldehid və ammonium xloridlə reaksiya məhsulundan üçlü amini ayıran zaman müşahidə etmişdir. Sonralar, Petrenko-Kritçenko və onun əməkdaşları bu tipli kondensasiyanı öyrənmişlər, lakin onlar bu reaksiyanın ümumi xarakterini müəyyən edə bilməmişlər.
1917-ci ildə Mannix, antipirin salisilatın formaldehid və NH4Cl-lə qarşılıqlı təsirindən üçlü aminin əmələ gəlməsini müşahidə etməsi, başladığı tədqiqatlarına hərtərəfli təkan verdi. Belə ki, 4-dimetilaminoantipirin oxşar reaksiyaya girmədiyindən, tamamilə aydın olur ki, reaksiyada iştirak edən antipirin molekulunda 4 vəziyyətində olan hidrogen atomudur.
Baş verən çevrilmələrin dəqiq mexanizmi müəyyən edilməmişdir. Hazırda güman edilir ki, Mannix reaksiyası, CH2O və amindən əvvəlcə imin(ium) duzları , sonra isə amin törəmələri əmələ gəlməsilə baş verir.

Nitrolaşma reaksiyası
Nitrolaşma reaksiyası – üzvi birləşmələrə nitroqrupun (-NO2) müxtəlif üsullarla daxil edilməsi prosesinə deyilir. Karbohidrogen atomunda bir və ya bir neçə hidrogen atomun nitroqrup ilə əvəz olunmasıdan əmələ gələn birləşmələrə nitrobirləşmələr deyilir.
Nitroqrupun birləşdiyi karbohidrogen radikalından asılı olaraq nitrobirləşmələr 2 yerə bölünür: aromatik və alifatik nitrobirləşmələr.
Aromatik nitrobirləşmələr çox böyük tətbiq sahələrinə malikdir. Onlardan boyaq sənayesində, dərman preparatları, partlayıcı maddələr və s. istehsalında istifadə olunur. Nitrobenzol əsasən (90%-ə qədər) anilin istehsalına, boyaların sintezinə (2%-ə qədər), və s. sərf olunur.
Aromatik nitrobirləşmələr – rəngsiz və ya açıq sarı rəngdə yüksək temperaturda mayelərdir, ya da aşağı temperaturda əriyən bərk maddələrdir. Yüksək polyarlığına görə nitroarenlər yaxşı həlledicidirlər.

Nukleofilik əvəzetmə reaksiyaları
Nukleofilik əvəzetmə reaksiyaları (ing. nucleophilic substitution reaction) — bölüşdürülməmiş elektron cütü daşıyan reagent-nukleofilin hücumu həyata keçirdiyi əvəzetmə reaksiyalarıdır. Nukleofilik əvəzetmə reaksiyalarında tərk edən qrupa nukleofuq deyilir.
Bütün nukleofillər Lyuis əsaslarıdır.
Nukleofilik əvəzetmə reaksiyalarının ümumi görünüşü:
R - X + Y - → R - Y + X - ( burada Y - anion nukleofilidir)
R - X + Y - Z → R - Y + X - Z (burada Y - Z neytral nukleofildir)
Alifatik (geniş yayılıb) və aromatik (geniş yayılmayıb) nukleofilik əvəzetmə reaksiyaları mövcuddur.
Alifatik nukleofilik əvəzetmə reaksiyaları üzvi sintezdə çox vacib rol oynayır və həm laboratoriya təcrübəsində, həm də sənayedə geniş istifadə olunur.
Mövcud faktları və müşahidələri ümumiləşdirərək nukleofilik əvəzetmə reaksiyalarının mexanizmini izah edən bir nəzəriyyə 1935-ci ildə İngilis alimləri Edvard Hughes və Christopher Ingold tərəfindən hazırlanmışdır.
SN1 reaksiyasının və ya monomolekulyar nukleofilik əvəzetmə reaksiyasının (ing. substitution nucleophilic unimolecular) mexanizmi aşağıdakı mərhələləri əhatə edir:
1. Karbokationın (yavaş mərhələ) yaranması ilə substratın ionlaşması:
R - X → R+ + X-
2.

Nüvə reaksiyası
Radioaktivlik 1896-cı ildə fransız alimi Anri Bekkerlium tərəfindən müəyyən edilmişdir. O qeyd etmişdir ki, uran saxlayan maddələr özlərindən görünməyən şüalar buraxır, bu da fotoplyonkanı işıqlandırır, ağacdan, kağızdan və bütün bərk maddələrdən keçə bilir. Bundan bir qədər sonra məşhur fransız fizikləri Mariya Skladovskaya-Kyüri və Pyer Kyüri müəyyən etdilər ki, «U»-dan əlavə «Th» torium və «Pa» planium eyni şüa buraxma qabiliyyətinə malikdir. 1898-ci ildə radium izotopu tapıldı. Aparılan müşahidələr göstərdi ki, radiumun verdiyi şüalanmanın ardıcıllığı, urandan milyon dəfə çoxdur. Bekkerli və Mariya Kyüri bir qədər sonra radiumun insan orqanizminə güclü təsirini müşahidə etdilər.
Dayanıqlığı az olan elementlərin atom nüvələri özbaşına parçalana bilir, bu zaman yeni element atomu nüvələri və radioaktiv şüalar adlanan xüsusi növlü şüalar əmələ gəlir. Bu hadisə radioaktivlik adlanır. Öz-özünə parçalanan izotop isə radioaktiv izotop adlanır.
Hazırda radioaktiv parçalanma zamanı yaranan şüalara ionlaşdırıcı və yaxud nüvə şüaları adı verilmişdir.

Oksidləşmə-reduksiya reaksiyaları
Oksidləşmə-reduksiya reaksiyaları (ing. Reduction-Oxidation; qısa adı:Redox və ya Redox reactions; mənası: Reduction - azaltma, Oxidation - yüksəltmə) — atomların oksidləşmə dərəcəsinin dəyişməsi ilə gedən reaksiyalara deyilir. Oksidləşdiricidə elektron alınır, reduksiyaedicidə elektron itirilir. Atomlarda oksidləşmə dərəcəsinin dəyişməsi elektronların bir atomdan digərinə keçməsi nəticəsində baş verir. Oksidləşmə vaxti elementin oksidləşmə dərəcəsi artır. Oksidləşmə və reduksiya prosesləri vahid bir prosesin iki hissəsidir. Yəni reduksiya olmadan oksidləşmə və ya tərsinə, oksidləşmə olmadan reduksiya gedə bilməz. Qarşılıqlı kimyəvi təsir zamanı elektron qəbul edən maddələr oksidləşdiricilər, əksinə, elektron verən maddələr isə reduksiyaedicilər adlanır. Beləliklə, oksidləşmə-reduksiya prosesində reduksiyaedicinin müəyyən sayda elektronu oksidləşdiriciyə keçir. Nəticədə, reduksiyaedici oksidləşir, oksidləşdirici isə reduksiya olunur.

Pfitzinger reaksiyası
Pfitzinger reaksiyası (həmçinin Pfitzinger-Borşe reaksiyası kimi tanınır) — əvəzlənmiş xinolin-4-karbon turşuları əldə etmək üçün izatinlə əsas və aldehidin kimyəvi reaksiyasıdır.
İzatinin kalium hidroksid kimi əsasla reaksiyası ketoturşunun (2) alınması üçün amid rabitəsinin hidrolizi baş verir. Bu aralıq məhsul təcrid oluna bilər, lakin adətən bu baş vermir. Keton (və ya aldehid) imin (3) və enaminin (4) alınması üçün anilin ilə reaksiyaya daxil olacaqdır. Enamin istənilən xinolinin (5) alınması üçün tsiklləşəcək və dehidratlaşacaq.
N-asil izatinlərin əsaslarla reaksiyasından 2-hidroksi-xinolin-4-karbon turşuları alınır.[6]
^ Pfitzinger, W. (1886). "Chinolinderivate aus Isatinsäure". J. Prakt. Chem. (in German).

Piktet-Spenqler reaksiyası
Piktet-Spengler reaksiyası — β-aril- etilaminin aldehid və ya keton ilə kondensasiyaya məruz qaldığı və sonra həlqənin bağlandığı kimyəvi reaksiyadır. Reaksiya ilk dəfə 1911-ci ildə Amé Piktet və Teodor Spenqler (22 fevral 1886 – 18 avqust 1965) tərəfindən kəşf edilmişdir.[1] Ənənəvi olaraq protik həlledicidə turşu katalizatoru qızdırma zamanı istifadə olunurdu[2], lakin sonradan reaksiyanın aprotik mühitdə daha yüksək məhsuldarlıqla getdiyi öyrənilmişdir.[3] Piktet-Spenqler reaksiyasını Mannix reaksiyasının xüsusi halı hesab etmək olar. Bu reaksiyanın hərəkətverici qüvvəsi turş mühitdə aldehid və aminin kondensasiyası nəticəsində yaranan iminium ionunun elektrofilliyidir. Bu, əksər hallarda turşu katalizatoruna ehtiyacla izah edilir, çünki imin həlqəsi bağlanmaq üçün kifayət qədər elektrofil deyil, lakin iminium ionu bu reaksiyaya daxil olur.
Piktet-Spenqler reaksiyası həm sənayedə, həm də biosintezdə geniş istifadə olunur. Aşkar olunduğu gündən bəri alkaloid və üzvi sintez sahələrində əhəmiyyətli bir reaksiya olaraq qalmışdır, burada bir çox β-karbolinlərin alınmasında istifadə edilmişdir. Təbii Piktet-Spenqler reaksiyası adətən striktosidin sintaza kimi bir fermentindən istifadə edir. Bioloji xammal kimi amin turşusu triptofan və müxtəlif aldozalar istifadə olunur.
İndol və ya pirol kimi nukleofil aromatik həlqələr mülayim şəraitdə yüksək məhsul verir, fenil qrupu kimi daha az nukleofil aromatik həlqələr isə daha az məhsul verir və ya daha yüksək temperatur və qüvvətli turşu tələb edir. Piktet-Spenqler reaksiyası, tetrahidroizoxinolini meydana gətirən xlorid turşusunun katalizatorluğu ilə fenetilamin və dimetoksimetanın reaksiyasıdır.

Polimeraz zəncir reaksiyası
Polimeraz zəncir reaksiyası (PZR) (ing. polymerase chain reaction, PCR) — biokimya və molekulyar biologiya sahələrində DNTnin, E.coli və ya maya kimi hərhansı bir canlı orqanizm istifadə edilmədən sadəcə ferment vasitəsilə külli miqdarda çoxaldılması üçün istifadə edilən metoddur. PZR çağdaş genetik mühəndisliyinin əsas metodlarından biri sayılır və molekulyar genetikanın inkişafında böyük rol oynamışdır. Kari Mullis tərəfindən 1983-cü ildə icad edilən metod, ona Nobel mükafatını qazandırıb.
Metod DNT-nin müəyyən region və ya regionlarının süni şəraitdə (orqanizmdən kənarda)(in vitro) DNT polimeraz fermenti vasitəsilə müəyyən nahiyəni seçərək təkrar təkrar kopyalanması prinsipinə əsaslanır. Adətən PZR metodu ilə 10 kb (kilo əsas cütü) böyüklüyə qədər DNT çoxaltmaq mümkündür, ancaq bəzi metodlar 40 kb uzunluqda hissənin çoxaldılmasına belə imkan verir.
Ən sadə PZR metodunun tətbiqi üçün aşağıdaki komponentlər lazımdır:
İçində çoxaldılmaq istənilən regionu saxlayan DNT.
Regionun sonlarına tamamlayıcı olan iki növ praymer.
İstiliyə davamlı DNT polimeraz fermenti.
Dörd növ dezoksiribonukleotid fosfat (A, G, C, T)
Fermentin çalışması üçün optimal şərait yaradan bufer məhlulu.
Divalent kation, {adətən maqnezium ancaq manqan da istifadə oluna bilər}.

Pomeranz-Fritiş reaksiyası
Pomeranz-Fritş reaksiyası- həmçinin Pomeranz-Fritş tsiklləşməsi adlanır, üzvi kimyaya aid reaksiyadır. Paul Fritş (1859–1913) və Casar Pomeranz (1860–1926) adlı alimlərin adını daşıyır. Ümumiyyətlə, bu reaksiya izoxinolinin sintezidir.
Aşağıdakı reaksiya benzaldehid və 2,2-dialkoksietilamindən izoxinolinin sintezini əks etdirir.
Müxtəlif alkil qrupları, məsələn metil və etil qrupları əvəzedici (R) kimi istifadə edilə bilər. Reaksiyada sulfat turşusu proton donoru kimi (bəzən trifluorasetik anhidrid və lantanid triflatlar kimi Luis turşuları) istifadə olunurdu.[1][2][4] Daha sonra geniş çeşiddə müxtəlif izoxinolinlər uğurla sintez olunmuşdur.
Əvvəlcə benzalaminoasetal benzaldehid və 2,2-dialkoksietilaminin kondensasiyası nəticəsində sintez olunur. Kondensasiyadan sonra alkoksi qruplarından birinə hidrogen atomu əlavə olunur. Bunun nəticəsində spirt alınır. Daha sonra, birləşmə 2 sintez olunur.

Reaksiyalar
Kimyəvi reaksiya — maddənin tərkib və xassələrinin dəyişməsi ilə baş verən hadisəyə Edvin teoremi deyilir. Kimyəvi reaksiyalar həmişə fiziki hadisələrlə müşayət olunur. Fiziki hadisə zamanı maddənin tərkibi dəyişmir, yalnız forması, həcmi və aqreqat halı dəyişir. Kimyəvi reaksiyaları aşağıdakı xarici əlamətlərə görə müəyyən etmək olur:
İstiliyin ayrılması və ya udulması;
İşığın ayrılması;
Rəngin dəyişməsi;
Çöküntünün əmələ gəlməsi və ya itməsi;
Qaz halında maddənin ayrılması;
İyin çıxması.
Kimyəvi reaksiyaların baş verməsi üçün reaksiyaya daxil olan maddələr bir-biri ilə təmasda olmalı və əksər hallarda qızdırılmalıdır. Bərk maddələrin xırdalanması və qarışdırılması reaksiyanın başlanmasına kömək edir və reaksiyanı sürətləndirir. Kimyəvi reaksiyanın gedişinin əmsallar və formullar vasitəsilə şərti yazılışına kimyəvi tənlik deyilir. Kimyəvi tənliklər tərtib edilərkən maddə kütləsinin saxlanması və maddə tərkibinin sabitliyi qanunlarından istifadə edilir. Hər tənlik ox işarəsi ilə birləşmiş iki hissədən ibarətdir. Sol tərəfdə reaksiyaya girən maddələrin, sağ tərəfdə isə reaksiya nəticəsində alınan maddələrin formulları yazılır:
2H2 + O2 → 2H2O
Kimyəvi reaksiya haqqında əsas məlumatları əldə etmək üçün onun sürətini bilmək vacibdir.

Rozenmund reaksiyası
Rozenmund-Zayçev reaksiyası — aldehid xloridlərin hidrogenlə aldehidlərə selektiv katalitik azaldılması reduksiyasına deyilir. Reaksiya 1872-ci ildə M.M.Zayçev tərəfindən kəşf edildi, klassik dəyişiklik 1918-ci ildə Rosenmund tərəfindən inkişaf etdirildi.
Katalizator metal paladium (BaSO4, CaCO3, BaCO3, asbest, kömür, diatomlu torpaq), bəzən Pt və Ni götürülür. Aldehidlərin reduksiya olunmasının qarşısını almaq üçün katalizatordan istifadə olunur. Həlledici (benzol, toluen və s.). katalizator, 80-180 °C-də, 150-200 °C-də buxar faza hidrogenləşmə istifadə olunur.. Alkoqollar, karbohidrogenlər və turşular tez-tez yan məhsullar kimi meydana gəlir [spirtlərdən və RC (O) Cl) əmələ gəlir.
Əsas aralıq məhsullar - spirtlər, karbohidrogenlər, turşular[spirtlərdən və RC (O) C1) əmələ gəlmişdir. Daha az və daha az miqdarda anhidridlər-t, oliqomerlər və polimerlər əmələ gəlir.
Rosemund şərtləri altında, dikarboktsilb turşu xloridlərindən to-t-ə qədər olan reaksiyalar.

Skraup reaksiyası
Skraup reaksiyası — Zdenko Hans Skraup adını daşıyır. Reaksiya tipi — tsiklin əmələ gəlməsi ilə gedən reaksiya.
Skraup sintezi xinolinləri sintez etmək üçün istifadə edilən kimyəvi reaksiyadır. Çexiyalı kimyaçısı Zdenko Hans Skraupun (1850–1910) şərəfinə adlandırılmışdır. Skraup reaksiyasında anilin sulfat turşusu, qliserin və nitrobenzol ilə qızdırılır və xinolin sintez edilir.
Bu nümunədə nitrobenzol həm həlledici, həm də oksidləşdirici agent kimi iştirak edir. Əks halda şiddətli reaksiya olduğu üçün əsasən dəmir(II)sulfatın iştirakı ilə aparılır.[5] Nitrobenzol əvəzinə arsen turşusu istifadə edilə bilər və birincisi daha yaxşıdır, çünki reaksiya daha az şiddətlə gedir.[6]
Bisçler-Napieralski reaksiyası
Doebner-Miller reaksiyası
^ Skraup, Z. H. (1880). "Eine Synthese des Chinolins". Berichte. 13: 2086.