
































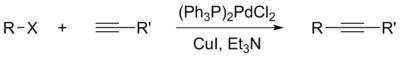
ру фотохимическая реакция en photochemical reaction de photochemische Reaktion fr réaction photochimique es reacción fotoquímica it reazione fotochimi
Tam oxu »ру каталитическая реакция en catalytical reaction de katalytische Reaktion fr réaction catalytique es reacción catalítica it reazione catalitica
Tam oxu »ру обращаемая химическая реакция en reversible chemical reaction de reversible chemische Reaktion fr réaction chimique réversible es reacción química
Tam oxu »...Orqanizmin xarici və ya daxili təxərrüşə münasibəti. Orqanizmin soyuğa qarşı reaksiyası. 2. Əhvalda baş verən kəskin dəyişiklik; gərginlikdən, yüksəl
Tam oxu »I сущ. реакция: 1. действие, возникающее в ответ на какое-л. воздействие. Tamaşaçıların reaksiyası реакция зрителей 2. физиол., биол. ответ организма
Tam oxu »

































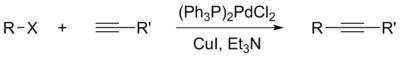
[lat. re...-əks və actio-hərəkət] реакция (1. са таъсирдиз жаваб яз арадал къведай таъсир; // физиол. биол. къеце патай ва я къенепатай жедай эсердиз
Tam oxu »Re latınca “əks”. “zidd” deməkdir. Reaksiya “aksiyanın (hərəkətin) tərsi” kimi başa düşülür (hərəkətə qarşı əks hərəkət). (Bəşir Əhmədov. Etimologiya
Tam oxu »1. Adətən reaksiya dedikdə bir məlumata «cavab» nəzərdə tuturuq. 2. Bax, həm də ünsiyyət effekti.
Tam oxu »...təəssürata cavab olan hərəkət, hal, proses. Məsələn, psixoloji reaksiya; 2) kimyəvi, fiziki, yaxud bioloji təsirlə, müəyyən şərait yaratmaqla aparıla
Tam oxu »soyuqqanlı olmaq, münasibət bildirməmək, əhəmiyyət verməmək; ~ baş qoşmamaq.
Tam oxu »прым. ланцуговая, ланцуговае, ланцуговыя zəncirvarı ланцуговая рэакцыя — zəncirvarı reaksiya
Tam oxu »РЕАКЦИЯ I ж reaksiya (1. bax реагирование; 2. kəskin dəyişiklik, düşkünlük, zəiflik (yüksəlişdən, gərginlikdən sonra); 3. kim. maddələr arasında kimyə
Tam oxu »...порядки. Политическая реакция. Эпоха реакции. Борьба против реакции, с реакцией.
Tam oxu »реакция (1. революциядиз, прогрессдиз, вилик финиз аксивал. 2. къеце патай жедай эсердиз организмдин жаваб; эсердикай хабар кьун, гьадаз килигай с
Tam oxu »1. reaksiya; 2. kəskin dəyişiklik, düşkünlük, zəiflik; 3 maddələr arasında kimyəvi münasibət
Tam oxu »əmtəənin keyfiyyətinin aşağı olması, sayının az olması, yaxud xarab olması aşkarlandıqda satıcının ticarət əqdi bağlanıldıqda əmtəənin topdansatış qiy
Tam oxu »...Mətni işləmə və düzəltmə, redaktə etmə. Protokolun son redaksiyası. Əsərin redaksiyasını mütəxəssisə tapşırmaq. 2. Hər bir nəşrin (kitabın, məcmuənin
Tam oxu »I сущ. редакция: 1. проверка и исправление текста при подготовке к печати. Romanın redaksiyası редакция романа 2. разг. руководство изданием книги, жу
Tam oxu »I. i. 1. (bina) editorial office; 2. (işi) editorship; ~sı ilə / altında edited (by); ilk ~ first / original wording II
Tam oxu »[lat. redaction-qaydaya, səliqəyə salma] редакция (1. кхьенвай са затӀунин винел кӀвалахна адан кимивилер, гъалатӀар дуьзар хъувун; редактироватун; 2.
Tam oxu »REDAKSİYA Dedim redaksiyada oxuyuram, elə ki, bəyəndilər, çap etməli oldular, gətirib Mina xanımı da tanış edərəm (M.İbrahimov); QƏZETXANA (köhn.) [Hə
Tam oxu »...məzmun və formasını təkmilləşdirməkdən ibarət yaradıcı prosesdir. Redaksiya şərti olaraq siyasi, ədəbi və elmi növlərə ayrılır; 2) mətnşünaslıqda ədə
Tam oxu »редакция (1. сада кхьей затI басмадиз гудалди вилик килигна, кимивилер, гъалатар дуьзарна гьазурун. 2. литературадин произведениедин вариантрикай-жу
Tam oxu »[lat. reducere – qaytarmaq, geri çəkmək] 1. xüs. Mürəkkəb haldan sadə hala keçmə, bir şeyin bu və ya başqa cəhətdən azalması, zəifləməsi
Tam oxu »...prosesi хим. восстановительный процесс, reduksiya reaksiyası восстановительная реакция
Tam oxu »...вследствие преломления лучей в атмосфере II прил. рефракционный. Refraksiya hadisəsi рефракционное явление
Tam oxu »сущ. резекция (хирургическая операция удаления больного органа). Mədənin rezeksiyası резекция желудка
Tam oxu »[fr. fraction – pay, hissə] kim. Distillə edilən maye qatışığının ayrıldığı hissəciklər. Neftin fraksiyası
Tam oxu »...üzvlərindən ibarət mütəşəkkil qrup. [Ceyran:] Rəyasət heyəti üzvüyəm. Fraksiya iclasına gedirəm. S.Hüseyn. 2. Siyasi partiyada: partiyanın ümumi xətt
Tam oxu »...программой, отличной от общей линии партии II прил. фракционный. Fraksiya qrupları фракционные группы, fraksiya mübarizəsi фракционная борьба 2 хим.,
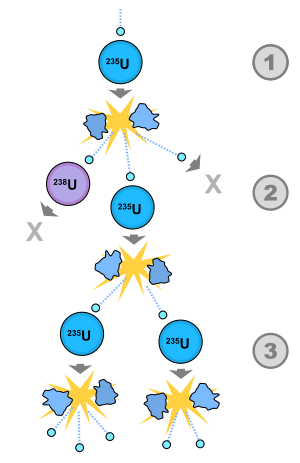
Tam oxu »sif. Zəncir kimi; davamlı, sürəkli, silsiləli. Zəncirvari reaksiya. Zəncirvari hörgü.
Tam oxu »прил. цепной. физ., хим. Zəncirvari reaksiya цепная реакция; zəncirvari refleks цепной рефлекс
Tam oxu »...cavab vermək; 2. reaksiya vermək; to ~ to kindness xoş münasibətə reaksiya vermək; How did they respond to the news? Onlar xəbərə necə reaksiya verdi
Tam oxu »прич. 1. yarılmış, 2. parçalanmış; 3. kim. hissələrə ayrılmış (kimyəvi reaksiya vasitəsilə).
Tam oxu »сов. 1. yarılmaq; 2. parçalanmaq; 3. kim. hissələrə ayrılmaq (kimyəvi reaksiya vasitəsilə).
Tam oxu »сов. 1. yarmaq; 2. parçalamaq; 3. kim. hissələrə ayırmaq (kimyəvi reaksiya vasitəsilə).
Tam oxu »1. reaksiya, təsirə cavab vermə, təsirlənmə; 2. münasibət göstərmə, əlaqə göstərmə, baxma
Tam oxu »anlamamaq, deyilən sözü qanmamaq, irad və ya nəsihətə reaksiya verməmək.
Tam oxu »...çəkmə, utanma; 2) acığı tutma, hirslənmə; 3) həyəcana gəlmə, coşma; 4) reaksiya.
Tam oxu »...-, -en med. bədənin bir şeyi tərk etmə nəticəsində göstərdiyi reaksiya
Tam oxu »vi reaksiya vermək, münasibətini bildirmək, təpki göstərmək, əksül-əməl göstərmək, dillənmək
Tam oxu »adj 1. təsirə cavab verən; reaksiya verən; 2. qıcığa cavab verən; 3. kim. reaktiv
Tam oxu »...hazır vəziyyətdə olmaq, ayıq olmaq, gözlənilən hər şeyə cəld reaksiya vermək.
Tam oxu »...geri qaytarma; 2) inkar etmə; 3) qəbul etməmə; 4) cavab vermə, reaksiya vermə; 5) qovma.
Tam oxu »deyimin denotat, konnotativ və praqmatik mənasının alıcı tərəfindən qavranılması.
Tam oxu »