Radikal (kimya)

Kimyadakı sərbəst radikallar - xarici elektron qabığında bir və ya daha çox boşaldılmış elektron hissəciklər.
Sərbəst radikallar bərk, maye və qazlı maddələrdir və çox qısa (saniyənin bir hissəsi) çox uzun müddətə (bir neçə ilədək) mövcud ola bilər. Radikallar yalnız neytral deyil, həm də ion (radikal ionlar) ola bilər və eyni zamanda birdən çox boşaldılmayan elektrona malikdirlər (məsələn, biradikallarda). Sərbəst radikallar paramaqnetik xüsusiyyətlərə malikdir və çox reaktiv hissəciklərdir[1].
Kəşfi tarixi
[redaktə | mənbəni redaktə et]Sərbəst radikalların mövcudluğu XIX əsrdə təkrarlanmışdı.1849-cu ildə İngilis kimyaçı Eduard Franklend, etil radikalının olduğuna inanaraq yodetanı sinklə qızdıraraq butan əldə etdi. Bənzər bir səhv Alman kimyaçısı German Kolbe tərəfindən etilin metil radikalı kimi qəbul edilməsi ilə edildi[2].

Həlldəki ilk sərbəst radikal Amerikalı kimyaçı Musa Qomberq tərəfindən kəşf edildi. 1900-cü ildə o, trifenilmetil xlorid üzərində gümüşün təsiriylə əldə edərək trifenilmetil radikalını kəşf etdi. Bu radikalın olması səbəbindən məhlul sarı rəngə boyandı və sonra bu radikalın dimerinin ağ kristalları məhluldan çıxdı[2].
1901-ci ildə nitroksil quruluşunun sərbəst bir radikalı olan porfireksid əldə edildi, ancaq onu qəbul edənlər O idi. Pilotlar və B. Şverin onu radikal kimi tanımadılar[1].
1929-cu ildə Alman kimyaçısı Fridrix Panet metil və etil radikallarını təyin etdi. Bir eksperimentdə o, tetrametil qurğuşunu istiyə davamlı bir şüşə boruda hidrogen axınında parçaladı. Bu vəziyyətdə, borudan aşağı bir hidrogen axını ilə gedən metil radikallar və daxili diametrə güzgü şəklində düşən metal qurğuşun meydana gəldi. Tetrametil qurğuşun parçalanma yerindən 30 sm məsafədən sonra, daha əvvəl qoyulmuş qurğuşun güzgü borunun içərisində idi. Keçən metil radikalları bu qurğuşun ilə reaksiya göstərərək yenidən quraşdırma sonunda qatılaşmış tetrametil qurğuşun meydana gətirdi. Eyni təcrübə, parçalanma yeri və qurğuşun güzgü arasındakı məsafəni, həmçinin hidrogen axınının sürətini dəyişdirərək radikalların ömrünü qiymətləndirməyə imkan verdi. Təcrübə şəraitində (1–2 mm Hg Art.) təqribən 0.0084 saniyə təşkil etdi[2].
1930-cu ildə G. A. Razuvaev və V. N. İpatiev karbon tetrakloriddə dimetil civənin fotolizini tədqiq etdilər və müəyyən etdilər ki, proses zamanı yalnız civə - karbon qazının homolitik parçalanması zamanı əmələ gələ biləcək bu cür məhsullar əmələ gəlir.Bu, sərbəst radikalların həll yollarında mövcud ola biləcəyinə dəlil oldu.[2]
Quruluşu və sabitlik
[redaktə | mənbəni redaktə et]Sərbəst radikallar σ-elektron və π-elektronlara bölünür.σ—elektronradikallarında boşalmayan bir elektron σ— orbitalda yerləşir. Nəticədə, açılmamış bir elektron olan bir atom hibridləşməsini saxlayır və radikal orijinal molekul ilə demək olar ki, eyni quruluşa malikdir.σ— elektron radikallarına fenil (C6H5•),vinil (CH2=CH•) və formil (HC•=O) radikalları, həmçinin karboksil (CO2-•) və piridil(C5H5N+•) radikal ionları daxildir.Bu cür radikallarda boşalmayan elektron zəif bir şəkildə ayrılır. Məsələn, fenil radikalda, radikal mərkəzdə spin sıxlığı 0.9918-dir və yalnız orto-protonlarla əhəmiyyətli qarşılıqlı əlaqə müşahidə olunur[1][3].
π-elektron radikallarında,boşalmayan bir elektron p-orbitalda yerləşir və bunun nəticəsində radikal mərkəzdə sp2—hibridləşir. Ətrafdakı atomlar bu vəziyyətdə bu orbitalın nodal düzənliyində yerləşir və radikal çox kiçik bir inversiya enerji maneəsi olan düz üçbucaq və ya aşağı piramida şəklindədir. π-elektron radikallarına, məsələn, alkil, allil və benzil radikalları daxildir. Bunlardan metil radikal düz, CF3• и C(CH3)3•radikallar aşağı piramidadır. Bu, məsələn, trifluorometil radikalının sıfır olmayan dipol anının olması ilə təsdiqlənir (0.43 D)[3].
Nəticədə, alifatik radikalların seriyasında termodinamik sabitlik aşağıdakı kimi dəyişir[3]:
Kinetik sabitlik, digər molekullara və radikallara münasibətdə bir radikalın reaktivliyi ilə əlaqələndirilir. Kinetik sabitliyə ilk növbədə reaksiya mərkəzinin yaxınlığında böyük əvəzedicilərin olması təsir göstərir. Reaktivin radikala yaxınlaşmasına sterik maneələr kifayət qədər böyükdürsə, onda belə bir radikal sərbəst formada olduqca uzun müddət mövcud ola bilər. Reaktivin radikala yaxınlaşmasına sterik maneələr kifayət qədər böyükdürsə, onda belə bir radikal sərbəst formada olduqca uzun müddət mövcud ola bilər[3].
Qısa ömürlü sərbəst radikallar
[redaktə | mənbəni redaktə et]Qısamüddətli, boşalmayan elektronun lokallaşdırıldığı, yəni qonşu orbitlərin iştirakı və ya toplu əvəzedicilərin iştirakı ilə sabitləşmə mexanizmləri olmayan sərbəst radikallardır.Qısamüddətli radikallar, məsələn, NH2·, CH3·, OH·, SiH3· və digər radikallardır. Bu cür radikallar ya güclü soyutma (maye helium, hidrogen, azot və ya arqon ilə), ya da hüceyrənin təsiri ilə sərbəst radikallar aşağı temperaturda vitrifik edilmiş həlledici molekullarla əhatə olunduqda sabitləşməlidir[1].
Qısamüddətli sərbəst radikallar bir maddə üzərində müxtəlif fiziki və ya kimyəvi cəhətdən hərəkət edərək yaranır.Tipik bir nümunə, Kolbe reaksiyası zamanı natrium asetatın elektrolizi zamanı metil radikalının əmələ gəlməsidir[1].
Qısamüddətli radikallar da fotolizi nəticəsində əmələ gəlir. Bu vəziyyətdə bir maddənin udduğu bir kvantın enerjisi kimyəvi bağlarından birinin dissosiasiya enerjisini üstələməlidir[1].
- .
Müvafiq əlaqənin aşağı dissosiasiya enerjisi olan bəzi üzvi birləşmələr piroliz zamanı sərbəst radikalları verir. Beləliklə, üzvi peroksidlərin (benzoyl peroksid, tert-butil hidroperoksid, kumil peroksid, tert-butil peroksid) istiləşməsi O-O bağının homolitik parçalanmasına və iki radikalın yaranmasına səbəb olur[1].
.
Uzun ömürlü sərbəst radikallar
[redaktə | mənbəni redaktə et]Uzun ömürlü sərbəst radikallar qısa ömürlü olanlardan fərqlənir ki, onlarda boşalmayan elektron güclü şəkildə yerləşmişdir və reaksiya mərkəzi fəza çətinliyi yaradan və bu mərkəzin reaktivliyini aşağı salan böyük əvəzedicilərlə əhatə olunmuşdur[1]. Bunlar müxtəlif kimyəvi reaksiyalar, o cümlədən tək elektron ötürmə reaksiyaları və radikal mərkəzə təsir etmədən reaksiyalar yolu ilə əldə edilir[1].
Bu sinif sərbəst radikalların tipik nümayəndələri arilmetil radikallardır. Onlardan bəziləri otaq temperaturunda rənglənir, sabit kristal və ya 6·1023 spin/ mole qoşulmamış elektrondan ibarət amorf maddədir. Məsələn, sözdə inert radikallar (C6Cl5)2C•Cl, (C6Cl5)3C•, (C6Cl5)2C•C6H4OH (narıncı-qırmızı rəngə malikdir və yüksək temperaturda əriyir[1].
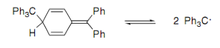
Həlllərdə bu radikallar dimer molekulları ilə tarazlıqda mövcuddur. Bu tarazlığın mövqeyi, yəni radikalın dimerə nisbəti, həm sol, həm də elektron və məkan təsirlərindən təsirlənir[1]. Əvvəlcə dimmerlərdə heksaaretanların quruluşu olduğu düşünülürdü, lakin sonradan bir quinoid quruluşunun olduğu göstərildi[3].
| Radikal | Dissosasiya dərəcəsi, % | Radikal | Dissosasiya dərəcəsi, % |
|---|---|---|---|
| Ph3C• | 2 | трет-Bu(п-PhC6H4)2C• | 74 |
| (п-PhC6H4)Ph2C• | 15 | (Ph2C=CH)Ph2C• | 80 |
| (β-C10H7)3C• | 24 | (п-PhC6H4)3C• | 100 |
| (α-C10H7)Ph2C• | 60 | (Ph3C)Ph2C• | 100 |
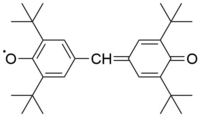
Aroksil radikalları da uzun ömürlüdürlər, tez bir zamanda oksigenlə reaksiya verirlər, buna görə də onlarla işləmək bir inert atmosfer və ya vakuum tələb edir. Fenolların oksidləşməsində vasitəçi kimi meydana gəlirlər. Qalvinoksil radikal saf formada 158 °C pl ilə ,indofenoksil radikal 136 °C pl ilə təcrid olunur[1].
 |
 |

Radikal mərkəzin azot atomunun üzərində olduğu bir çox uzun ömürlü radikal var. Beləliklə, 25 °C-də sabit olan amin radikalları ikincil aminlərin oksidləşməsi ilə əldə edilir. Verdazil radikalları ən sabit üzvi paramaqnitlərdən biridir. Otaq temperaturunda havada onların yarı ömrü uzun illər ola bilər[1].
Nitroksil radikalları quruluşuna görə amin oksidlərinə bənzəyir. Bunlardakı radikal mərkəz azot atomuna bağlı oksigen atomunun üzərində yerləşir. Bəzi nitroksil radikalları, içərisindəki boşaldılmamış elektronun delokalizasiyaya uğramamasına baxmayaraq çox sabitdir. Belə bir sabit radikalın məşhur bir nümunəsi 38 °C pl ilə tünd qırmızı 2,2,6,6- tetrametilpiperidin-1-oksildir(TEMPO). Bununla birlikdə, boşalmayan bir elektronun delokalizasiyasının yaxşı ifadə olunduğu və reaksiya mərkəzinin həcmli əvəzedicilərlə əhatə olunduğu digər strukturlar da var[1].
Iminoksil radikallarının ümumi düsturu belədir: RR’C=NO•. İkiqat bir bağın olması səbəbindən, onlar cis və trans izomerləri şəklində mövcud ola bilərlər[1].
Kimyəvi xassələri
[redaktə | mənbəni redaktə et]Sərbəst radikallar boşalmayan bir elektrona sahib olduqları üçün xarakterik kimyəvi xüsusiyyətlər nümayiş etdirirlər. Beləliklə, boşalmayan bir elektron olan digər hissəciklərlə sərbəst radikallarla (özləri ilə birlikdə), metallarla və molekulyar oksigenlə reaksiya girirlər:[3].
Sərbəst radikallar da asanlıqla atomlara parçalanan birləşmələrlə reaksiyaya girə bilirlər.[3].
Bir radikal bir hidrogen atomunu digər bir radikaldan qopara bilər: bu, nisbətlə nəticələnir (biri doymuş və biri doymamış birləşmə yaranır) və sistemdəki radikalların ümumi sayı azalır[3].
Radikal mərkəz köçürmə reaksiyaları ayrıca, ikiqat bağlantı yolu ilə hidrogen ayrılması və ya radikal birləşmə nəticəsində boşalmayan bir elektronun başqa bir hissəcikdə görünməsi ilə fərqlənir[3].
Bundan əlavə radikalların β-mövqedə bir bağ qırılması ilə çürüdükdə əksinə reaksiyalar da var. Bu cür parçalanma, xüsusən də bir neçə çürümə yolunun olması halında daha sabit bir alkil radikalının meydana gəldiyi birinə üstünlük verən alkoksil radikalları üçün xarakterikdir[3].
Sərbəst radikallar yenidən birləşmə reaksiyaları ilə xarakterizə olunur, lakin radikallar halında, hidrogen atomları və alkil qrupları nadir hallarda köçürlər (karbokasiyaların yenidən qurulmasından fərqli olaraq). Bir fenil qrupunun və ya halogen atomlarının miqrasiyası daha çox yayılmışdır[3].
Aşkarlanması və təhlili
[redaktə | mənbəni redaktə et]
Sərbəst radikallar paramaqnitik xüsusiyyətlərinə görə aşkar edilir. Əsasən bunun üçün elektron paramaqnitik rezonans (EPR) metodu istifadə olunur. EPR spektrləri yalnız sərbəst radikalları aşkar etməyə imkan vermir, həm də onların quruluşu və boşalmamış bir elektronun delokalizasiya dərəcəsi haqqında məlumat əldə etməyə imkan verir. Bunun üçün iki parametr istifadə olunur: g-faktoru və hiperfinin parçalanma sabitliyi. Bunlardan birincisi, NMR spektroskopiyasındakı kimyəvi dəyişikliyin analoqudur[3].
Ultrafın parçalanması, boşalmayan bir elektronun bir radikalın maqnit nüvələri ilə qarşılıqlı təsiri nəticəsində baş verir.Bir elektron spin sayı I olan bir nüvə ilə qarşılıqlı əlaqə qurarsa, parçalanma nəticəsində 2I+1 xətti meydana gəlir. Bir neçə belə nüvə varsa, məsələn n, onda xətlərin sayı 2nI+1-ə bərabər olar. Protonun spin sayı +½ olduğundan n ekvivalent protonlar EPR spektrindəki xətti n+1 xətlərinə bölürlər.Bu xətlərin nisbi intensivliyi binom əmsallarına uyğundur[3].
Trifenilmetil radikalının spektri daha da mürəkkəbdir, çünki orada boşalmayan bir elektron orto mövqedə 6 ekvivalent proton, meta mövqeyində 6 ekvivalent proton və para mövqeyində 3 ekvivalent proton ilə qarşılıqlı təsir bağışlayır. Bu vəziyyətdə, ekvivalent protonların hər qrupundakı xətlərin sayı çoxaldılmalıdır, buna görə də bu kationun EPR spektrindəki xətlərin ümumi sayı 7 × 7 × 4 = 196 təşkil edir. Mürəkkəb radikalların spektrləri nəzəri spektrləri hesablamaq və eksperimental ilə müqayisə etməklə deşifr olunur[3].

Nümunədəki sərbəst radikalların konsentrasiyası eyni vaxtda standartın və tədqiq olunan nümunənin spektrini qeyd etməklə müəyyən edilir.Sonra siqnal intensivliyi müqayisə olunur. Difenilpikrilhidrazil radikal Ph2N-N•-C6H2(NO2)3 bir istinad olaraq tez-tez istifadə olunur. Tünd bənövşəyi rəngə sahib olan eyni radikal, dinamikada radikalların meydana gəlməsini və istehlakını izləməyə imkan verir, çünki digər radikallarla qarşılıqlı əlaqədə olduqda rəng sarıya dəyişir və ya yox olur[3].
Kompleks sərbəst radikallar ikiqat elektron-nüvə rezonansı (DEAR) və nüvələrin kimyəvi qütbləşməsi üsulları ilə araşdırılır. Kompleks sərbəst radikallar ikiqat elektron-nüvə rezonansı (DEAR) və nüvələrin kimyəvi qütbləşməsi üsulları ilə araşdırılır[1].
Tətbiqi
[redaktə | mənbəni redaktə et]Uzun ömürlü sərbəst radikallar oksidləşmə və polimerləşmə proseslərinin qarşısını almaq üçün stabilizator kimi istifadə olunur: xüsusən də, akrilonitril, vinil asetat, viniliden xlorid, stirol, furfural, piylər və yağları sabitləşdirirlər. Molekulyar biologiyada onlar spin etiket kimi istifadə olunur. Bundan əlavə, foto materialların istehsalında, polimer örtüklərin istehsalında, cihazlarda, geofizikada və qüsurların aşkar edilməsində istifadə olunur[1].
Qısa müddətli radikallar təbiətdə müxtəlif kimyəvi reaksiyalarda, məsələn, radikal halogenləşmədə aralıq hissəciklər şəklində tapılır[1].
Sərbəst radikallar insan orqanizmində normal həyat dövründə də: prostaqlandinlərin biosintezi zamanı, mitoxondriya və faqositlərin işində yaranır. Bədəndə radikalların meydana gəlməsi yaşlanma ilə əlaqələndirilir[1].
Həmçinin bax
[redaktə | mənbəni redaktə et]İstinadlar
[redaktə | mənbəni redaktə et]Ədəbiyyat
[redaktə | mənbəni redaktə et]- Розанцев Э. Г. Радикалы свободные. 4. 154–157.
- Днепровский А. С, Темникова Т. И. Теоретические основы органической химии. 6. Л.: Химия. 1991. ISBN 5-7245-0206-2.
- Берберова Н. Т. "Из жизни свободных радикалов" (PDF). 2019-10-31 tarixində arxivləşdirilib (PDF).








![{\displaystyle {\mathsf {CH_{3}COO^{-}{\xrightarrow[{}]{-e^{-}}}CH_{3}COO^{\cdot }{\xrightarrow[{}]{-CO_{2}}}{CH_{3}}^{\cdot }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b3e525f52aaed6657de44d0bb8187b72d29252a)
![{\displaystyle {\mathsf {Ph_{2}Hg{\xrightarrow[{}]{hv}}Ph^{\cdot }+PhHg^{\cdot }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/66a0e0739f5323636757bf8941fd6dcb6c05b481)
![{\displaystyle {\mathsf {(CH_{3})_{3}COOC(CH_{3})_{3}{\xrightarrow[{}]{t}}2(CH_{3})_{3}CO^{\cdot }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/14e59319db3dee6e1332c591805df71eb8d42b2a)








