is. [ yun. chloros – yaşımtıl-sarı] Texnikada, sanitariyada – zərərsizləşdirici, hərbi işlərdə isə zəhərləyici maddə kimi işlədilən yaşımtıl-sarı rəngli boğucu kimyəvi maddə – qaz.

Xlor
Xlor (Cl) – D. İ. Mendeleyevin elementlərin dövri sistemində 17-ci element.
Xlor kəskin iyli sarımtıl – bərk maddedir Birinci dünya müharibəsində xlordan zəhərləyici maddə kimi istifadə
edilmişdir. Kimyəvi reaksiyalarda tərkibində xlor olan birləşmələrdən və xlorlu sudan xlor aldıqda o, təhlükəli sayılır. Tərkibində xlor olan ağardıcılardan istifadə etdikdə də otağın havasını yaxşı dəyişmək lazımdır. Xlorun hətta kiçik dozası nəfəs yollarını güclü qıcıqlandırır.
Bitkilərin orqanizmində xlorun miqdarı təxminən kütləcə 0,1 %-dir. Bu bütün canlı orqanizmlərdə su-duz mübadiləsinin əsas elementlərindən biridir. Bəzi bitkilər (halofitlər – şoranlıqlarda bitən bitkilər) yüksək qatılıqda natrium xloridə malik duzlu torpaqlarda inkişaf etmək qabiliyyəti ilə yanaşı xloridləri də toplamaq qabiliyyətinə malikdirlər. Onlara şoran ot, yulgün və s. aiddir.

Alüminium xlorid
Alüminium xlorid – alüminium duzu və xlorid turşusu. Kimyəvi formulu — AlCl3.
== Xassəsi ==
Adi temperaturada 183°C-də uçur (təzyiq altında 192,6 °C-də əriyir). Suda yaxşı həll olur (25 °C temperaturda 100 qr H2O-da 44,38 qr); nəm havada hidroliz nəticəsində tüstülənməyə başlayır və HCl ayrılır. Sulu məhluldan sarımtıl-ağ rəngdə kristalohidrat — AlCl3• 6H2O formasında məhlulda asılı şəkildə üzən kristal ayrılır. Bir sıra üzvi birləşmələrdə yaxşı həll olur (məsələn, 25 °C temperaturda 100 qr etanolda 100 qr, asetonda, dixloretanda, etilenqlikolda, nitrobenzolda, karbondördxloriddə və s.).
== Alınması ==
Alüminium xloridin sənayedə alınmasının ən əhəmiyyətli üsulu — Cl2 və CO qarışığının şaxta sobalarında susuzlaşdırılmış kaolin və ya boksitə təsirinə əsaslanır:
AI2O3 + 3CO + 3Cl2 ↔ 2AICI3+3CO2 • 6H2O3
900 °C temperaturda bor üçxlorid və alüminium fosfid qarışığından bor fosfid və alüminium xlorid alınır:
BCI3 + AIP → BP + AICI3
Alüminium xloridin digər alınma üsulları da mövcuddur:
AI + FeCI3 → AICI3 + Fe
AI (OH)3 + 3HCI → AICI3 + 3H2O
CuCI2 + AI → 2AICI3 + 2Cu
AI + 6HCI → AICI3 + 3H2
== Tətbiqi ==
Susuz alüminium xlorid bir sıra qeyri üzvi (məsələn, NH3, H2S, SO2) və üzvi (məsələn, turşuların xloranhidridləri, efirlər və s.) maddələrlə birləşmə məhsullarını əmələ gətirir. Bu da AlCl3 neft emalında və üzvi sintezlərdə (məsələn Fridel – Krafts reaksiyasında) katalizator kimi texniki tətbiqinin mühüm əhəmiyyət kəsb etdiyini gəstərir. Heksahidrat və onun məhlulları qrunt sularının təmizlənməsi, ağac emalı və digər sahələrdə istifadə olunur.
== Toksikliyi ==
Alüminium xlorid orqanizmə daxil olduqda çox toksikdir, həm də korroziya aktivliyinə malikdir.
Flüorkarbon və xlorflüorkarbon yağları
Flüorkarbon və xlorflüorkarbon yağlar – son illərdə yüksək temperatura və yeyici kimyəvi maddələrin təsirinə davamlı mayelərə və sürtkü yağlarına tələbat artmışdır. Flüorkarbon və xlorflüorkarbon yağlar üzvi birləşmələr bu cür maddələrdəndir. Flüorkarbon karbohidrogenlərdən hidrogen atomlarını flüorla əvəz etmək yolu ilə alınır. Flüorkarbon yağları təmamilə flüorlaşmış parafin, naften və aromatik karbohidrogenlərdən, yaxud yanzəncirli və qarışıq tipli karbohidrogenlərdən əmələ gəlir. Flüorlu törəmələri ən əlverişli istehsal üsulu karbohidrogenlərin kobalt florid vasitəsilə flüorlaşdırılmasıdır. Bu maddə güclü flüorlaşdırıcı xassəyə malikdir və flüorlaşdırma prosesində karbohidrogenin quruluşunu pozmur:
-CH2+4CoF3 → CF2-+2HF + 4CoF2
== Fiziki — kimyəvi xassələri ==
Flüorkarbonlar şəffaf, rəngsiz və ya aşıq sarı rəngli, müxtəlif özlülüklü iysiz mayelərdir. Onlar petroleyn efirindən, etil efirindən, xlorlaşdırılmış karbohidrogenlərdən yaxşı həll olur, suda , spirtlərdə və benzolda həll olmur. Fiziki – kimyəvi xassələrinə görə bu birləşmələr karbohidrogenlərdən kəskin fərqlənir. Onlar kimyəvi və termiki sabitdir. Belə ki, onlar hətta 1000C-dən yuxarı temperaturlarda qatı nitrat turşusu, tüstülənən sulfat turşusu, nitrolaşdırıcı qarışıq, qatı hidrogen-peroksid, xrom turşusu kimi güclü oksidləşdiricilərlə reaksiyaya girmir.

Kadmium(II)xlorid
Kadmium (II) xlorid (CdCl2) — qeyri-üzvi bir birləşmədir, kadmium metalının və xlorid turşusunun duzu, rəngsizkristallar, higroskopik, suda asanlıqla həll olunur,
kristallohidratlar əmələ gətirir.
== Fiziki xassələri ==
Kadmium (II) xlorid heksoqonal sistemin rəngsiz
kristallarını, fəza qrupunu R-3m, hüceyrə parametrlərini a = 0.385 nm, c = 1.746 nm, Z = 3 əmələ gətirir. Sulu məhlulları hidrolizə görə turş reaksiya yaradır. Metalik kadmium(6000C-də kadmiumun~ 15%) kadmium xloridin ərintisində həll olunur.
== Alınması ==
Metalik kadmiumun xlorid turşusunda həll edilməsi nəticəsində almaq olur:
C
d
+
2
H
C
l
→
τ
C
d
C
l
2
+
H
2
↑
{\displaystyle {\mathsf {Cd+2HCl\ {\xrightarrow {\tau }}\ CdCl_{2}+H_{2}\uparrow }}}
Kadmium oksidin xlorid turşusunda həll edilməsi:
C
d
O
+
2
H
C
l
→
C
d
C
l
2
+
H
2
O
{\displaystyle {\mathsf {CdO+2HCl\ {\xrightarrow {}}\ CdCl_{2}+H_{2}O}}}
Sadə maddələr arasındakı reaksiya nəticəsində:
C
d
+
C
l
2
→
450
−
500
o
C
C
d
C
l
2
{\displaystyle {\mathsf {Cd+Cl_{2}\ {\xrightarrow {450-500^{o}C}}\ CdCl_{2}}}}
Kadmium oksidin və xlor qazı ilə reaksiyası nəticəsində:
2
C
d
O
+
2
C
l
2
→
500
−
600
o
C
2
C
d
C
l
2
+
O
2
{\displaystyle {\mathsf {2CdO+2Cl_{2}\ {\xrightarrow {500-600^{o}C}}\ 2CdCl_{2}+O_{2}}}}
== Kimyəvi xassələri ==
Kristallohidratların qızdırılması nəticəsində susuz duzları alınır:
C
d
C
l
2
⋅
2
,
5
H
2
O
→
120
−
170
o
C
C
d
C
l
2
+
2
,
5
H
2
O
{\displaystyle {\mathsf {CdCl_{2}\cdot 2,5H_{2}O\ {\xrightarrow {120-170^{o}C}}\ CdCl_{2}+2,5H_{2}O}}}
Hidrogen xloridlə və qələvi metal xloridlərlə kompleks yaradır:
C
d
C
l
2
+
2
H
C
l
→
H
2
[
C
d
C
l
4
]
{\displaystyle {\mathsf {CdCl_{2}+2HCl\ {\xrightarrow {}}\ H_{2}[CdCl_{4}]}}}
C
d
C
l
2
+
2
K
C
l
→
K
2
[
C
d
C
l
4
]
↓
{\displaystyle {\mathsf {CdCl_{2}+2KCl\ {\xrightarrow {}}\ K_{2}[CdCl_{4}]\downarrow }}}
Qaynar qatı sulfat turşusu ilə reaksiyaya daxil olur:
C
d
C
l
2
+
H
2
S
O
4
→
100
o
C
C
d
S
O
4
+
2
H
C
l
↑
{\displaystyle {\mathsf {CdCl_{2}+H_{2}SO_{4}\ {\xrightarrow {100^{o}C}}\ CdSO_{4}+2HCl\uparrow }}}
Qələvilərlə reksiyaya daxil olur:
C
d
C
l
2
+
2
N
a
O
H
→
C
d
(
O
H
)
2
+
2
N
a
C
l
{\displaystyle {\mathsf {CdCl_{2}+2NaOH\ {\xrightarrow {}}\ Cd(OH)_{2}+2NaCl}}}
== Tədqiqi ==
Fotoreagentlərdə.
Qalvanik elementlərdə elektrolitin tərkib hissəsi kimi.
Üzvi sintezdə katalizator kimi.
Sənayedə günəş panellərinin istehzalı zamanı.
== İstinadlar ==
Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр.
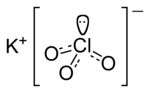
Kalium xlorat
Kalium xlorat — (Bertol duzu , kalium perklorat) — perklor turşusunun kalium duzu.
== Tarixi ==
Əvvəlcə Klod Lui Bertolle ( Bertol duzu buradan adlanır) tərəfindən 1786-cı ildə xlorun kalium hidroksidinin isti bir konsentrasiyalı məhlulu ilə keçməsi zamanı əldə edildi:
6
K
O
H
+
3
C
l
2
→
K
C
l
O
3
+
5
K
C
l
+
3
H
2
O
{\displaystyle {\mathsf {6KOH+3Cl_{2}\rightarrow KClO_{3}+5KCl+3H_{2}O}}}
== Alınması ==
Ümumiyyətlə xloratın sənaye istehsalı (və xüsusən kalium xloratı) hipokloritlərin nisbi reaksiyasına əsaslanır və bu da öz növbəsində xlorun qələvi məhlulu ilə qarşılıqlı təsiri nəticəsində əldə edilir:
C
l
2
+
2
O
H
−
→
C
l
O
−
+
C
l
−
+
H
2
O
{\displaystyle {\mathsf {Cl_{2}+2OH^{-}\rightarrow ClO^{-}+Cl^{-}+H_{2}O}}}
3
C
l
O
−
→
C
l
O
3
−
+
2
C
l
−
{\displaystyle {\mathsf {3ClO^{-}\rightarrow ClO_{3}^{-}+2Cl^{-}}}}
Prosesin texnoloji dizaynı fərqli ola bilər: ən yüksək tonnajlı məhsul kalsium hipoklorit olduğundan (ağartmanın bir hissəsidir), ən çox yayılmış proses nisbətən az həllolma qabiliyyətinə görə ana liköründən kristallaşan kalsium xlorat (istilik yolu ilə kalsium hipokloritdən əldə edilir) ilə kalium xlorid arasındakı mübadilə reaksiyasındadır.
Kalium xloratı, kalium xloridinin diafraqma olmayan elektrolizi vəziyyətində dəyişdirilmiş Bertoll üsulu ilə alınır, elektroliz zamanı əmələ gələn xlor kalium hipokloritini yaratmaq üçün kalium hidroksidi ilə yerində (təcrid olunmuş anda "yerində") qarşılıqlı təsir göstərir,bu da kalium xlorat və orijinal kalium xlorid nisbətini artırır. Qrafit anodlarından istifadə edərkən daha əlverişli bir üsul, natrium xloratın çıxarılması üçün sodium xloridin elektrolizi və kalium xloru ilə mübadilə reaksiyasıdır. Bu, anod çamurundan natrium xloratın bir həllini təmizləməyinizə imkan verir, bu, kalium xloratından qat-qat çox həllolma qabiliyyətinə malikdir və beləliklə süzülmək üçün daha əlverişlidir.
== Kimyəvi xassələri ==
~ 400 ° C temperaturda kalium perxloratın aralıq meydana gəlməsi ilə oksigen buraxılmaqla parçalanır:
4
K
C
l
O
3
→
400
o
C
3
K
C
l
O
4
+
K
C
l
{\displaystyle {\mathsf {4KClO_{3}{\xrightarrow[{}]{400^{o}C}}3KClO_{4}+KCl}}}
K
C
l
O
4
→
550
−
620
o
C
K
C
l
+
2
O
2
{\displaystyle {\mathsf {KClO_{4}{\xrightarrow[{}]{550-620^{o}C}}KCl+2O_{2}}}}
Katalizatorların iştirakı ilə (MnO2, Fe2O3, CuO və s.) parçalanma istiliyi əhəmiyyətli dərəcədə azalır (~ 200 ° C-ə qədər).
2
K
C
l
O
3
→
150
−
300
o
2
K
C
l
+
3
O
2
{\displaystyle {\mathsf {2KClO_{3}{\xrightarrow[{}]{150-300^{o}}}2KCl+3O_{2}}}}
Ammonium xloratın meydana gəlməsi ilə su-spirtli bir həllində ammonium sulfat ilə reaksiya verir:
(
N
H
4
)
2
S
O
4
+
2
K
C
l
O
3
→
2
N
H
4
C
l
O
3
+
K
2
S
O
4
{\displaystyle {\mathsf {(NH_{4})_{2}SO_{4}+2KClO_{3}\rightarrow 2NH_{4}ClO_{3}+K_{2}SO_{4}}}}
== Tətbiqi ==
Kalium xlorat katalizator iştrakı ilə qızdırıldıqda maddənin bir qismi parçalanır. Bu zaman normal şəraitə hesablanmaqla 6,72 litr qaz və 16 q bərk qalıq əmələ gəlir. Qalığa 170 q 30%-li gümüş nitrat məhlulu əlavə olunur. Son məhlulda gümüş nitratın kütlə payını hesablayın.

Maqnezium xlorid
Maqnezium xlorid (MgCl2) – qeyri-üzvi birləşmədi, xlorid turşusunun maqnezium duzu.
== Fiziki xassələri ==
Magnezium xlorid – susuz duzdur, hiqroskopik heksoqonal
Rəngsiz kristallar şəklində kristallaşır. Acı dadı var.
== Alınması ==
Susuz maqnezium xloridi maqneziumun birbaşa xlorlanması nəticəsində almaq olar:
M
g
+
C
l
2
→
M
g
C
l
2
{\displaystyle {\mathsf {Mg+Cl_{2}\rightarrow MgCl_{2}}}}
Magnezium xloridi əsası oksidlərin xlorid turşusu ilə reaksiyası zamanı almaq olar:
2
M
g
O
+
2
C
l
2
→
2
M
g
C
l
2
+
O
2
{\displaystyle {\mathsf {2MgO+2Cl_{2}\rightarrow 2MgCl_{2}+O_{2}}}}
M
g
O
+
C
+
C
l
2
→
M
g
C
l
2
+
C
O
{\displaystyle {\mathsf {MgO+C+Cl_{2}\rightarrow MgCl_{2}+CO}}}
== Kimyəvi xassələri ==
Magnezium xlorid suda yaxşı həll olunur, piridində, spirtlərdə, asetonda zəif həll olunur.
Magnezium xlorid qələvilər və ammonyak məhlulu ilə reaksiya girir:
M
g
C
l
2
+
2
N
a
O
H
→
M
g
(
O
H
)
2
↓
+
2
N
a
C
l
{\displaystyle {\mathsf {MgCl_{2}+2NaOH\rightarrow Mg(OH)_{2}\downarrow +\,2NaCl}}}
Magnezium xloridə natrium karbonat əlavə edildikdə, əsası maqnezium karbonatın çöküntüsü əmələ gəlir:
5
M
g
C
l
2
+
5
N
a
2
C
O
3
+
2
H
2
O
→
M
g
(
O
H
)
2
⋅
3
M
g
C
O
3
↓
+
M
g
(
H
C
O
3
)
2
+
10
N
a
C
l
{\displaystyle {\mathsf {5MgCl_{2}+5Na_{2}CO_{3}+2H_{2}O\rightarrow Mg(OH)_{2}\cdot 3MgCO_{3}\downarrow +\,Mg(HCO_{3})_{2}+\,10NaCl}}}
M
g
C
l
2
+
2
N
a
H
C
O
3
→
M
g
C
O
3
↓
+
2
N
a
C
l
+
H
2
O
+
C
O
2
↑
{\displaystyle {\mathsf {MgCl_{2}+2NaHCO_{3}\rightarrow MgCO_{3}\downarrow +\,2NaCl+\,H_{2}O+CO_{2}\uparrow }}}
2
M
g
C
l
2
+
L
i
A
l
H
4
→
M
g
H
2
+
L
i
C
l
+
A
l
C
l
3
{\displaystyle {\mathsf {2MgCl_{2}+LiAlH_{4}\rightarrow MgH_{2}+\,LiCl+\,AlCl_{3}}}}
M
g
C
l
2
⋅
6
H
2
O
→
120
∘
C
M
g
C
l
2
⋅
4
H
2
O
+
2
H
2
O
{\displaystyle {\mathsf {MgCl_{2}\cdot 6H_{2}O\xrightarrow {120^{\circ }C} MgCl_{2}\cdot 4H_{2}O+2H_{2}O}}}
M
g
C
l
2
⋅
4
H
2
O
→
150
∘
C
M
g
C
l
2
⋅
2
H
2
O
+
2
H
2
O
{\displaystyle {\mathsf {MgCl_{2}\cdot 4H_{2}O\xrightarrow {150^{\circ }C} MgCl_{2}\cdot 2H_{2}O+2H_{2}O}}}
M
g
C
l
2
⋅
2
H
2
O
→
240
∘
C
M
g
C
l
2
⋅
H
2
O
+
H
2
O
{\displaystyle {\mathsf {MgCl_{2}\cdot 2H_{2}O\xrightarrow {240^{\circ }C} MgCl_{2}\cdot H_{2}O+H_{2}O}}}
M
g
C
l
2
⋅
H
2
O
→
>
300
∘
C
M
g
O
H
C
l
+
H
C
l
{\displaystyle {\mathsf {MgCl_{2}\cdot H_{2}O\xrightarrow {>300^{\circ }C} MgOHCl+HCl}}}
2
M
g
O
H
C
l
→
>
400
∘
C
M
g
2
O
C
l
2
+
H
2
O
{\displaystyle {\mathsf {2MgOHCl\xrightarrow {>400^{\circ }C} Mg_{2}OCl_{2}+H_{2}O}}}
== Tətbiqi ==
Maqnezium xlorid əsasən maqnezium istehsalında istifadə olunur. Həm çinin buz və qarın əriməsi üçün tətbiq olunur. Qarla təmasda olduqda onu tez bir zamanda əridir.
Magnezium xlorid qida sənayesində çox istifadə olunur. E 511 qida qatqısı kimi qeyd olunur.
== İstinadlar ==
Рабинович В.А., Хавин З.Я. Краткий химический справочник.

Natrium xlorid
NaCl və ya Natrium-xlorid – Xlorid turşusunun (HCl) turşu qalığının natriumlu duzudur. NaCl dəniz suyunda boldur və ona şor dad verir. Təbiətdə qalit (qaya duzu) şəklində yaranır. NaCl saf halda rəngsiz, kristallik maddədir. Amma xarici təsirlərə məruz qaldığı zaman mavi, bənövşəyi, çəhrayı, sarı və ya boz rənglərə çala bilir.

Polivinil xlorid
Polivinil xlorid (PVX) hazırda istehsal həcminə və tətbiq sahələrinə görə geniş yayılmış sintetik polimerlər sırasına daxildir. Ondan süni dəri, örtük və kabel-izolyasiya materialları, liflər və s. istehsal olunur. PVX əsasən, vinilxloridin emulsiyada və suspenziyada perosid inisiatorları iştirakı ilə 4-12 MPa təzyiqdə və 30-700-də polimerləşdirilməsi yolu ilə alınır. Alınan polimer "baş-ayaq" birləşməyə uyğun quruluşa malik olur.
PVX narın toz halındadır. Nisbətən aşağı molekul kütləli PVX asetonda, mürəkkəb efirlərdə, xlorlaşmış karbohidrogenlərdə həll olur. Daha yüksək molekul kütləli PVX isə tsikloheksanda, dimetilformamiddə, tetrahidrofuranda, dioksanda yaxşı həll olur.
Polivinil xlorid polietilendən sonra məişətdə ən geniş istifadə olunan sintetik polimerdir. PVX-dən boru, pəncərə çərçivəsi, jalyuzlar, döşəmə üçün qablamalar, oyuncaqlar və s.

Radium-xlorid
Radium-xlorid — Qələvi torpaq metallarından radium ən axırda kəşf edilmişdir, hələ D. İ. Mendeleyev onun üçün dövri sistemdə əvvəlcədən boş xana saxlamışdı. Radium 1898-ci ildə uran filizində tapıldı. Pyer və Mariya Kürilər bu mineralı tədqiq edərkən bəzi filiz nümunələrinin radioaktivliyinin onlardakı uranın miqdarına görə gözləniləndən böyük olduğunu müəyyən etdilər. Onlar belə nəticəyə gəldilər ki, uran filizinin tərkibində radioaktivliyi uranınkından yüksək olan yeni element vardır. Tezliklə onlar bu birləşməni ayıra bildilər. Radioaktiv parçalandığına görə elementi radium adlandırdılar. Kürilər təqribən bir ton uran filizini işləyərək, 0,1 q-a yaxın radium duzu aldılar. Radium metalı isə 1910-cu ildə civə katodundan istifadə etməklə Radium-xlorid məhlulunun elektrolizindən alındı.
Radium gümüşü – ağ rəngli ağır, çətinəriyən metaldır (6,5x10–4 atm təzyiqə tər=0,63C0). Digər qələvi – torpaq metallar kimi o da sərbəst halda yüksək kimyəvi aktivliyə malikdir, su ilə şiddətli reaksiyaya daxil olaraq hidrogen ayırır: Ra+2H2O=Ra(OH)2+H2.

Volfram (VI)xlorid
Volfram (VI) xlorid – qeyri-üzvi birləşmə, volfram və xlorid turşusunun duzudur.
Volfram (VI) xlorid tünd bənövşəyi kristallardı.180 °C-ə qədər olan temperaturda α-modifikasiyası sabitdir, triqonal sistem, hüceyrə parametrləri
a = 0,658 nm, α = 55°-dir. Spirtlərdə, efirdə, benzolda, karbon disulfiddə, karbon tetraxloriddəhəll olunur.
1. Volfram və xlorun reaksiyası nəticəsində alınır:
W
+
3
C
l
2
→
500
−
800
o
C
W
C
l
6
{\displaystyle {\mathsf {W+3Cl_{2}\ {\xrightarrow {500-800^{o}C}}\ WCl_{6}}}}
2. Tetraxlormetanın volfram(VI) oksidə təsiri nəticəsində:
W
O
3
+
3
C
C
l
4
→
450
o
C
,
p
W
C
l
6
+
3
C
C
l
2
O
{\displaystyle {\mathsf {WO_{3}+3CCl_{4}\ {\xrightarrow {450^{o}C,p}}\ WCl_{6}+3CCl_{2}O}}}
1. Qızdırıldıqda parçalanır:
2
W
C
l
6
→
350
o
C
2
W
C
l
5
+
C
l
2
{\displaystyle {\mathsf {2WCl_{6}\ {\xrightarrow {350^{o}C}}\ 2WCl_{5}+Cl_{2}}}}
2. Su ilə reaksiyaya daxil olur:
2
W
C
l
6
+
3
H
2
O
→
W
O
C
l
4
+
W
O
2
C
l
2
+
6
H
C
l
{\displaystyle {\mathsf {2WCl_{6}+3H_{2}O\ {\xrightarrow {}}\ WOCl_{4}+WO_{2}Cl_{2}+6HCl}}}
W
C
l
6
+
3
H
2
O
→
W
O
3
↓
+
6
H
C
l
{\displaystyle {\mathsf {WCl_{6}+3H_{2}O\ {\xrightarrow {}}\ WO_{3}\downarrow +6HCl}}}
3. Durulaşdırılmış qələvilərlə reaksiyaya daxil olur:
W
C
l
6
+
8
N
a
O
H
→
N
a
2
W
O
4
+
6
N
a
C
l
+
4
H
2
O
{\displaystyle {\mathsf {WCl_{6}+8NaOH\ {\xrightarrow {}}\ Na_{2}WO_{4}+6NaCl+4H_{2}O}}}
4. Hidrogenlə reduksiya olunur:
2
W
C
l
6
+
H
2
→
150
−
200
o
C
2
W
C
l
5
+
2
H
C
l
{\displaystyle {\mathsf {2WCl_{6}+H_{2}\ {\xrightarrow {150-200^{o}C}}\ 2WCl_{5}+2HCl}}}
3
W
C
l
6
+
2
A
l
→
450
o
C
3
W
C
l
4
+
2
A
l
C
l
3
{\displaystyle {\mathsf {3WCl_{6}+2Al\ {\xrightarrow {450^{o}C}}\ 3WCl_{4}+2AlCl_{3}}}}
5. Hidrogen floridlə reaksiyaya daxil olur:
6. Volfram(VI) oksidlə reaksiyaya daxil our:
W
C
l
6
+
6
H
F
→
t
W
F
6
+
6
H
C
l
{\displaystyle {\mathsf {WCl_{6}+6HF\ {\xrightarrow {t}}\ WF_{6}+6HCl}}}
W
C
l
6
+
2
W
O
3
→
400
o
C
3
W
O
2
C
l
2
{\displaystyle {\mathsf {WCl_{6}+2WO_{3}\ {\xrightarrow {400^{o}C}}\ 3WO_{2}Cl_{2}}}}
7. Üzvi volfram birləşmələrinin sintezi üçün xammal kimiistifadə olunur. Məsələn, dimetilcivə ilə reaksiyaya girərək metilpentaxlorvolfram alınır:
Volfram (VI) xlorid qeyri-metal səthlərdə örtük kimi istifadə olunur.
Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.

Xloral
Xloral (CCl3CHO) — rəngsiz spesifik iyə malik olan mayedir. İlk dəfə alman alimi Yustos fon Libix tərəfindən 1832-ci ildə etanolun xlorlaşdırılması zaman alınmışdır. Xloral suda həll olmur.

Xlorasetofenon
Xlorasetonfenon — Gözyaşardıcı zəhərli maddə.
Xlorasetofenon – sarı kristal halında olan bənövşə iyinə malik çox güclü zəhərli maddədir. İlk dəfə 1871-ci ildə alınmışdır. Ərimə temperaturu 50–800 °C, qaynama temperaturu 2450 C-dir. Xüsusi çəkisi 1,32 q/sm3-dir. Suda demək olar ki, həll olmur, üzvi həlledicilərdə yaxşı həll olur. Qələvilərin suda məhlulları xlorasetofenonu hidrolizləşdirir.
Bu maddənin xırda tozcuqları gözün selikli və buynuz qişalarına düşərsə, nəm qişada olan sinir uclarını ara kəsilmədən qıcıqlandırır və bunun nəticəsində yaşaxma baş verir. Zəhərlənmə əlamətləri adətən dərhal başlanır və 10–15 dəq. sonra maksimum həddə çatır.

Xlorasetonfenon
Xlorasetonfenon — Gözyaşardıcı zəhərli maddə.
Xlorasetofenon – sarı kristal halında olan bənövşə iyinə malik çox güclü zəhərli maddədir. İlk dəfə 1871-ci ildə alınmışdır. Ərimə temperaturu 50–800 °C, qaynama temperaturu 2450 C-dir. Xüsusi çəkisi 1,32 q/sm3-dir. Suda demək olar ki, həll olmur, üzvi həlledicilərdə yaxşı həll olur. Qələvilərin suda məhlulları xlorasetofenonu hidrolizləşdirir.
Bu maddənin xırda tozcuqları gözün selikli və buynuz qişalarına düşərsə, nəm qişada olan sinir uclarını ara kəsilmədən qıcıqlandırır və bunun nəticəsində yaşaxma baş verir. Zəhərlənmə əlamətləri adətən dərhal başlanır və 10–15 dəq. sonra maksimum həddə çatır.

Xlorbenzol
Xlorbenzol (fenilxlorid) – formulası C6H5Cl
Xlorbenzol — xarakterik bir qoxusu olan rəngsiz, yanıcı mayedir.
Xlorbenzol 1851-ci ildə fenolun fosfor pentaxlorid ilə keçən reaksiya zamanı alınıb. Laboratoriya şəraitində xlorbenzolun alınması bu reaksiya ilə alınır.
Sənayedə, xlorobenzolu dəmir halqalarla doldurulmuş sütun reaktorlarında 80–85 0C-də benzolun xlorlaşma reaksiyası zamanı almaq olar.
Vürs – Vitiq reaksiyası.
C
6
H
5
C
l
+
N
a
O
H
→
C
6
H
5
O
H
+
N
a
C
l
{\displaystyle {\mathsf {C_{6}H_{5}Cl+NaOH\rightarrow C_{6}H_{5}OH+NaCl}}}
Xlorobenzol vacib bir üzvi həlledicidir, həmçinin üzvi sintezdə istifadə olunur, məsələn, pestisidlərin sintezində istifadə olunur. Fenol istehsalında da istifadə olunur.
C
6
H
5
C
l
+
2
N
a
O
H
→
o
t
,
p
C
6
H
5
O
N
a
+
N
a
C
l
+
H
2
O
{\displaystyle {\mathsf {C_{6}H_{5}Cl+2NaOH\ \xrightarrow {^{o}t,\ p} \ C_{6}H_{5}ONa+NaCl+H_{2}O}}}
C
6
H
5
O
N
a
+
H
C
l
→
C
6
H
5
O
H
+
N
a
C
l
{\displaystyle {\mathsf {C_{6}H_{5}ONa+HCl\rightarrow C_{6}H_{5}OH+NaCl}}}
Xlorobenzol həmçinin dixlorbenzolların və bəzi boyaların istehsalında ara məhsuldur.
Xlorobenzol az zəhərli bir maddədir, amma nəfəs borusuna düşdükdə insana pis təsir edə bilər, ÖD 50 2900 mq / kq təşkil edir.
Рабинович В. А., Хавин З. Я. "Краткий химический справочник" Л.: Химия, 1977 стр.

Xloretan
Xloretan (lat. Aethylil chloridum) — rəngsiz, asan sıxılan qazdır, zəif xarakterik iyə malikdir , oddan təhlükəlidir. Tibbdə anesteziya üçün güclü soyuducu metod kimi istifadə olunur, əvvəllər bəzi hallarda inqalyasiya üçün narkoz kimi istifadə olunub.
Xloretan həmçinin xladaqent R-160 kimi tanınır.
Etilxlorid, Aether chloratus, Aethylis chloridum, Aethylium chloratum, Chelen, Chlorene, Chloretan, Ethylis chloridum, Ethyl chloride, Kelen, Xloristiy etil, Xloretan.
Xloretil güclü narkotik xassəli vasitədir. Nəfəslə udulan qarışıqda həcm etibarı ilə 3-4% xloretil olarsa cərrahi əməliyyat üçün narkoz mərhələsi yaranır. Narkoz 2-3 dəqiqə müddətdə baş tutur. Ayılma tez yaranır.
Etilxloridin əsas çatışmayan cəhəti qısa təsir müddətinə malik olması və bu səbəbdən də təkrar əlavə dozaya ehtiyac duyulduğu üçün təhlükəlidir.
Xlorid turşusu
Xlorid turşusu (HCl) — hidrogen və xlor elementlərindən ibarət olan, otaq istiliyi və normal təzyiqdə qaz halında olan kimyəvi bir mürəkkəbdir. IX əsrdə Ərəb kimyacı Cabir min Həyyan tərəfindən kəşf edildi və sonra simə sahəsində istifadə e dildi. Sənaye İnqilabı əsnasında, sənayedəki əhəmiyyəti kəşf edilən turşu, əvvəl Leblanc əməliyyatı, sonra Solvay əməliyyatı ilə sənaye sahəsində istehsal olunmağa başladı. Xlorid turşusu, tarixdə yeni asanlıqların kəşfində əhəmiyyətli rollar oynadı. Hal-hazırda PVC'den dəmir-polada, orqanik maddə istehsalından qida sektoruna qədər az qala bütün sahələrdə xlorid turşusundan istifadə edilməkdədir.
Xlorid turşusu, təmin etdiyi asanlıqlara baxmayaraq, zəhərli bir maddədir və insan toxumaları başda olmaq üzrə çoxu səthə böyük təxribat verir. Bu səbəblə bu turşu ilə çalışılarkən təhlükəsizlik tədbirləri ən üst səviyyədə tutulmalıdır. Turşu, toksik olmasıyla bərabər, gözlər və dəri üçün tahriş edəndir, dəridə yanıqlara səbəb olmaqdadır və tənəffüs sistemi üçün tahriş edici xüsusiyyət daşımaqdadır. Hidrogen xlor, normal şərtlərdə −27.32 °C də əriyər, 110 °C də qaynar. Xlorid turşusu əldə edə bilmək üçün əvvəlcə hidrogen xlor gazınının əldə etmək lazımdır.

Xlorit
Xloritlər - minerallar, Mg və Fe təbəqəli quruluşlu sulu metaalümosilikatlar, (Mg,Fe2+)3[(OH)2 | AlSi3O10] {(Mg,Fe3)3(OH)6}. Dioktaedrik və trioktaedrik xloritlər məlumdur; çoxunun quruluşu qismən, yaxud tamamilə nizamlanmamış olur. Geniş izomorf əvəzlənmələri məlumdur. Bütün xloritlər aşağıdakı ümümi xassələrə malikdir: monoklinik, ya da triklinik; habitus lövhəvari, lövhəciklər. İkiləşmə mika qanunu üzrə. İkiləşmə tikişi (001) və ikiləşmə oxu [001]; ayrılması {001} üzrə mükəmməl. Aqreqat: pulcuqvari, sferolit, oolit, gizlikristallik; əsasən yaşıl, lakin çəhrayı-qırmızı (Cr), qonuru-qara da (Fe-xlorit) olur. Sərtliyi 2-3-dür. Xüsusi çəki 2,6-3,3; Xloritlər şüasındırma qabiliyyəti Fe, Mg, Cr miqdarının artması ilə yüksəlir və SiO2 miqdarının azalması ilə azalır; ayrılma pulcuqları əyilgəndir, lakin qeyri-elastikdir. Xloritlər əsas etibarilə püskürmə süxurlarının Mg-Fe mineralları hesabına hidrotermal dəyişmə nəticəsində əmələ gəlir; yaşıl şistlərin metamorfizminin aşağı pilləsində.

Xloritlər
Xloritlər - minerallar, Mg və Fe təbəqəli quruluşlu sulu metaalümosilikatlar, (Mg,Fe2+)3[(OH)2 | AlSi3O10] {(Mg,Fe3)3(OH)6}. Dioktaedrik və trioktaedrik xloritlər məlumdur; çoxunun quruluşu qismən, yaxud tamamilə nizamlanmamış olur. Geniş izomorf əvəzlənmələri məlumdur. Bütün xloritlər aşağıdakı ümümi xassələrə malikdir: monoklinik, ya da triklinik; habitus lövhəvari, lövhəciklər. İkiləşmə mika qanunu üzrə. İkiləşmə tikişi (001) və ikiləşmə oxu [001]; ayrılması {001} üzrə mükəmməl. Aqreqat: pulcuqvari, sferolit, oolit, gizlikristallik; əsasən yaşıl, lakin çəhrayı-qırmızı (Cr), qonuru-qara da (Fe-xlorit) olur. Sərtliyi 2-3-dür. Xüsusi çəki 2,6-3,3; Xloritlər şüasındırma qabiliyyəti Fe, Mg, Cr miqdarının artması ilə yüksəlir və SiO2 miqdarının azalması ilə azalır; ayrılma pulcuqları əyilgəndir, lakin qeyri-elastikdir. Xloritlər əsas etibarilə püskürmə süxurlarının Mg-Fe mineralları hesabına hidrotermal dəyişmə nəticəsində əmələ gəlir; yaşıl şistlərin metamorfizminin aşağı pilləsində.

Xloritoid
Xloritoid — mineral. Tərkibi dəyişkəndir, Fe2+-nin Mg, Mn və Al-un Fe3+ əvəzlənməsi adidir. İki polimorf modifikasiyası vardır: monoklinik və triklinik. Habitus vərəqvari, qısa sütunvari. İkiləşmə {001} üzrə sadə, polisintetik və üçlüklər. Ayrılma {001} üzrə mükəmməl, {110} üzrə orta; sınma {010} üzrə. Tünd-yaşıl. Sərtliyi 6,5. Xüsusi çəki 3,5-3,8. Gilli çökmələrin regional metamorfizminin aşağı və orta pillələri üçün səciyyəvidir.

Xlorasetonitril
Xlorasetonitril — kimyəvi formulu: C2H2ClN olan rəngsiz, kəskin iyli maddədir.
Yanma temperaturu, alovlanma temperaturu — 56 °C Yanan maddə olduğuna görə istilik, qığılcımlanan və alov mənbələrindən uzaq olmalıdır. Sıx qapalı qabda, sərin, quru, yaxşı havalandırılan yerdə saxlanılmalıdır. Suda həll olmur. Sabitdir, su, nəm, güclü oksidləşdirici maddələr, turşular ilə reaksiya vermir. Qızdırıldıqda parçalanır. Bu, hidrogen siyanidi də daxil olmaqla zəhərli və tez alışan qazlar buraxır. Güclü oksidləşdiricilər, reduksiya edənlər, turşular, əsaslar və buxarla reaksiya verir. Xlorasetonitril çox zəhərli və yanan qazlar buraxır. N-oksifenil törəmələrinin sintezində Xlorasetonitrildən istifadə edilir.

1-Xlornaftalin
1-Xlornaftalin(α-xlornaftalin) – formulu C10H7Cl olan aromatik xlor üzvi birləşmədir.
== Fiziki xassəsi ==
1-Xlornaftalin rəngsiz yağlı mayedir.
== Alınması ==
Laboratoriya şəraitində 1-xlornaftalinin alınması, naftalinin yodud iştirakı ilə qaz şəklində olan xlorla xlorlaşma reaksiyası nəticəsində baş verir. Tərkibində 256 q naftalin, 450 q xlorbenzol və 1,3 q yod olan məhlulu qarışdıraraq qaynama dərəcəsinə çatdırırıq və xlor qazını daxil edirik. Sonra qarışıq soyudulur, uçucu turşuları və onların anhidridlərini çıxarmaq məqsədi ilə azotla təmizlənir və vakuumda qovulur. Maddənin çıxımı 80% (260–265 q) təşkil edir.
C
10
H
8
+
Cl
2
→
t
;
k
a
t
C
10
H
7
Cl
+
HCl
{\displaystyle {\ce {C10H8 + Cl2 ->[t; kat] C10H7Cl + HCl}}}
Alüminium xloridin iştirakı ilə naftalin ilə sulfurilxloridin reaksiyasınəticəsində almaq olar:
C
10
H
8
+
SO
2
Cl
2
→
A
l
C
l
3
C
10
H
7
Cl
+
HCl
+
SO
2
{\displaystyle {\ce {C10H8 + SO2Cl2 ->[AlCl3] C10H7Cl + HCl + SO2}}}
1-aminonaftalindən diazoniyum duzunun alınması və sonra Zandmeyer reaksiyasının aparılması nəticəsində almaq olar:
C
10
H
7
NH
2
+
HNO
2
+
HCl
⟶
C
10
H
7
N
2
Cl
+
2
H
2
O
{\displaystyle {\ce {C10H7NH2 + HNO2 + HCl ->[] C10H7N2Cl + 2H2O}}}
C
10
H
7
N
2
Cl
→
t
C
10
H
7
Cl
+
N
2
{\displaystyle {\ce {C10H7N2Cl ->[t] C10H7Cl + N2}}}
== Kimyəvi xassələri ==
1-Xlornaftalinin kimyəvi xassələri aromatik karbohidrogenlərin digər monoxlor törəmələri ilə oxşardır.
Yüksək temperaturda və təzyiqdə qələvilərlə hidroliz olunur:
C
10
H
7
Cl
+
H
2
O
→
t
;
p
C
10
H
7
OH
+
HCl
{\displaystyle {\ce {C10H7Cl + H2O ->[t; p] C10H7OH + HCl}}}
Efir mühitində litium ilə reaksiyaya girərək 1-naftillitium alınır:
C
10
H
7
Cl
+
2
Li
→
E
t
2
O
C
10
H
7
Li
+
LiCl
{\displaystyle {\ce {C10H7Cl + 2Li ->[Et2O] C10H7Li + LiCl}}}
Spirtli məhlulda kalium sionidlə reaksiyaya daxil olmur, lakin ~220°C temperaturda və təzyiq altında piridin məhlulunda susuz mis (I) sionid ilə 1-naftilnitril alınır:
2
C
10
H
7
Cl
+
2
CuCN
→
220
o
C
2
C
10
H
7
CN
+
Cu
2
Cl
2
{\displaystyle {\ce {2C10H7Cl + 2CuCN ->[220^oC] 2C10H7CN + Cu2Cl2}}}
== Tətbiqi ==
1-Xlornaftalin kənd təsərrüfatının müxtəlif sahələrində, üzvi boyaların alınmasında zərərvericilərini məhv etməsində geniş istifadə edilir.
== Toksikliyi ==
1-Xlornaftalin zəhərlidir, lakin 2-xlornaftalin istisna olmaqla, digər törəmələri arasında ən az təhlükəlidir. Dəri ilə təmasda olduqda müxtəlif dəri xəstəliklərinə, dermatitə səbəb olur.

1-Xlorpropan
1-Xlorpropan (С3H7Cl) — üzvi birləşmədir, hallogenalkanların nümayəndəsidir. 2-xloropropanın izomeridir.
== Fiziki xassələri ==
1-Xlorpropan rəngsis tez alışan mayedir. Xloroforma bənzər qoxusu var. Bir çox xloralkanlardan fərqli olaraq sudan yüngüldür, sıxlığı 0,89 q/ml təşkil edir.
== Alınması ==
1. Propanın xlorlaşması reaksiyası zamanı 2-xlorpropan ilə birlikdə alınır. Məhsulların nisbəti temperaturdan asılıdır.
Dimetilformiadın katalizi zamanı tionilxloridin propanol-1-ə təsiri nəticəsində:
2. Propan-1 –in xlorid turşusu ilə reaksiyası nəticəsində almaq olar:
3. Hidrogenləşmə reaksiyası:
== Kimyəvi xassələri ==
1-Xlorpropan suda pis həll olunur. Etil spirtində, dietil efirində, asetonda yaxşı həll olunur.
1. Vürs reaksiyası:
2. Dehidrogenləşmə reaksiyası
3. Fridel-Krafts reaksiyası:
CH
3
−
CH
2
−
CH
2
Cl
⇌
AlCl
3
CH
3
−
CH
(
Cl
)
−
CH
3
{\displaystyle {\ce {CH3-CH2-CH2Cl <=>[{\ce {AlCl3}}] CH3-CH(Cl)-CH3}}}
Reaksiya zamanı benzol çox götürülürki alkilləşmə davam etməsin.

Kadmium xlorid
Kadmium (II) xlorid (CdCl2) — qeyri-üzvi bir birləşmədir, kadmium metalının və xlorid turşusunun duzu, rəngsizkristallar, higroskopik, suda asanlıqla həll olunur,
kristallohidratlar əmələ gətirir.
== Fiziki xassələri ==
Kadmium (II) xlorid heksoqonal sistemin rəngsiz
kristallarını, fəza qrupunu R-3m, hüceyrə parametrlərini a = 0.385 nm, c = 1.746 nm, Z = 3 əmələ gətirir. Sulu məhlulları hidrolizə görə turş reaksiya yaradır. Metalik kadmium(6000C-də kadmiumun~ 15%) kadmium xloridin ərintisində həll olunur.
== Alınması ==
Metalik kadmiumun xlorid turşusunda həll edilməsi nəticəsində almaq olur:
C
d
+
2
H
C
l
→
τ
C
d
C
l
2
+
H
2
↑
{\displaystyle {\mathsf {Cd+2HCl\ {\xrightarrow {\tau }}\ CdCl_{2}+H_{2}\uparrow }}}
Kadmium oksidin xlorid turşusunda həll edilməsi:
C
d
O
+
2
H
C
l
→
C
d
C
l
2
+
H
2
O
{\displaystyle {\mathsf {CdO+2HCl\ {\xrightarrow {}}\ CdCl_{2}+H_{2}O}}}
Sadə maddələr arasındakı reaksiya nəticəsində:
C
d
+
C
l
2
→
450
−
500
o
C
C
d
C
l
2
{\displaystyle {\mathsf {Cd+Cl_{2}\ {\xrightarrow {450-500^{o}C}}\ CdCl_{2}}}}
Kadmium oksidin və xlor qazı ilə reaksiyası nəticəsində:
2
C
d
O
+
2
C
l
2
→
500
−
600
o
C
2
C
d
C
l
2
+
O
2
{\displaystyle {\mathsf {2CdO+2Cl_{2}\ {\xrightarrow {500-600^{o}C}}\ 2CdCl_{2}+O_{2}}}}
== Kimyəvi xassələri ==
Kristallohidratların qızdırılması nəticəsində susuz duzları alınır:
C
d
C
l
2
⋅
2
,
5
H
2
O
→
120
−
170
o
C
C
d
C
l
2
+
2
,
5
H
2
O
{\displaystyle {\mathsf {CdCl_{2}\cdot 2,5H_{2}O\ {\xrightarrow {120-170^{o}C}}\ CdCl_{2}+2,5H_{2}O}}}
Hidrogen xloridlə və qələvi metal xloridlərlə kompleks yaradır:
C
d
C
l
2
+
2
H
C
l
→
H
2
[
C
d
C
l
4
]
{\displaystyle {\mathsf {CdCl_{2}+2HCl\ {\xrightarrow {}}\ H_{2}[CdCl_{4}]}}}
C
d
C
l
2
+
2
K
C
l
→
K
2
[
C
d
C
l
4
]
↓
{\displaystyle {\mathsf {CdCl_{2}+2KCl\ {\xrightarrow {}}\ K_{2}[CdCl_{4}]\downarrow }}}
Qaynar qatı sulfat turşusu ilə reaksiyaya daxil olur:
C
d
C
l
2
+
H
2
S
O
4
→
100
o
C
C
d
S
O
4
+
2
H
C
l
↑
{\displaystyle {\mathsf {CdCl_{2}+H_{2}SO_{4}\ {\xrightarrow {100^{o}C}}\ CdSO_{4}+2HCl\uparrow }}}
Qələvilərlə reksiyaya daxil olur:
C
d
C
l
2
+
2
N
a
O
H
→
C
d
(
O
H
)
2
+
2
N
a
C
l
{\displaystyle {\mathsf {CdCl_{2}+2NaOH\ {\xrightarrow {}}\ Cd(OH)_{2}+2NaCl}}}
== Tədqiqi ==
Fotoreagentlərdə.
Qalvanik elementlərdə elektrolitin tərkib hissəsi kimi.
Üzvi sintezdə katalizator kimi.
Sənayedə günəş panellərinin istehzalı zamanı.
== İstinadlar ==
Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр.

Molibden (V) xlorid
Molibden (V) xlorid kimyəvi formulu MoCl5 olan qeyri-üzvi birləşmədir, molibden və xlorid turşusunun duzudur.
Molibden (V) xlorid monoklinik sinqoniyanın qara hiqroskopik kristallarını əmələ gətirir, fəza qrupu C 2/m. Dietil efirində, spirtlərdə, tetraxlormetanda, xloroformda, dixloretanda həll olunur.
Toz şəklində olan molibdenin və xlorun reaksiyası nəticəsində almaq olar:
2
M
o
+
5
C
l
2
→
400
−
500
o
C
2
M
o
C
l
5
{\displaystyle {\mathsf {2Mo+5Cl_{2}\ {\xrightarrow {400-500^{o}C}}\ 2MoCl_{5}}}}
Teraxlormetanın molibden (V) oksidin reaksiyası nəticəsində:
2
M
o
O
3
+
3
C
C
l
4
→
240
o
C
2
M
o
C
l
5
+
C
l
2
+
3
C
O
2
{\displaystyle {\mathsf {2MoO_{3}+3CCl_{4}\ {\xrightarrow {240^{o}C}}\ 2MoCl_{5}+Cl_{2}+3CO_{2}}}}
Yüksək temperaturda qızıdırıldıqda atmosferdə parçalamır:
M
o
C
l
5
→
>
268
o
C
M
o
C
l
3
+
C
l
2
{\displaystyle {\mathsf {MoCl_{5}\ {\xrightarrow {>268^{o}C}}\ MoCl_{3}+Cl_{2}}}}
NO_2\uparrow + 5HCl\uparrow }</math>
Hava rütubəti ilə reaksiya daxil olur:
M
o
C
l
5
+
H
2
O
→
M
o
C
l
3
O
+
2
H
C
l
{\displaystyle {\mathsf {MoCl_{5}+H_{2}O\ {\xrightarrow {}}\ MoCl_{3}O+2HCl}}}
Su ilə reaksiyası:
2
M
o
C
l
5
+
5
H
2
O
→
M
o
O
(
O
H
)
3
↓
+
H
2
[
M
o
C
l
5
O
]
+
5
H
C
l
{\displaystyle {\mathsf {2MoCl_{5}+5H_{2}O\ {\xrightarrow {}}\ MoO(OH)_{3}\downarrow +H_{2}[MoCl_{5}O]+5HCl}}}
İsti qatı nitrat turşusu ilə reaksiyası:
Qatı qəlivələrlə reaksiyası:
::
M
o
C
l
5
+
5
N
a
O
H
→
M
o
O
(
O
H
)
3
↓
+
5
N
a
C
l
+
H
2
O
{\displaystyle {\mathsf {MoCl_{5}+5NaOH\ {\xrightarrow {}}\ MoO(OH)_{3}\downarrow +5NaCl+H_{2}O}}}
Qızdırdıqda hava ilə oksidləşir:
::
2
M
o
C
l
5
+
O
2
→
200
o
C
2
M
o
C
l
4
O
+
C
l
2
{\displaystyle {\mathsf {2MoCl_{5}+O_{2}\ {\xrightarrow {200^{o}C}}\ 2MoCl_{4}O+Cl_{2}}}}
Hidrogenlə 900 °C-də molibdenə və 250 °C-də molibden (III) xloridə qədər reduksiya olunur:
2
M
o
C
l
5
+
5
H
2
→
900
o
C
2
M
o
+
10
H
C
l
{\displaystyle {\mathsf {2MoCl_{5}+5H_{2}\ {\xrightarrow {900^{o}C}}\ 2Mo+10HCl}}}
M
o
C
l
5
+
H
2
→
250
o
C
M
o
C
l
3
+
2
H
C
l
{\displaystyle {\mathsf {MoCl_{5}+H_{2}\ {\xrightarrow {250^{o}C}}\ MoCl_{3}+2HCl}}}
Natrium sulfid ilə molibden disulfidə qədər reduksiya olunur:
::
2
M
o
C
l
5
+
5
N
a
2
S
→
2
M
o
S
2
+
10
N
a
C
l
+
S
{\displaystyle {\mathsf {2MoCl_{5}+5Na_{2}S\ {\xrightarrow {}}\ 2MoS_{2}+10NaCl+S}}}
Molibden (V) xlorid molibden tozlarının hazırlanmasinda, qeyri-metal səthlərə molibden örtüyünün tətbiqində istifadə olunur.
Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
Неорганическая химия / под ред.
